
【题目】某结晶水合物的化学式为A·nH2O,其相对分子质量为M,在25℃时,ag晶体溶于bg水中即达饱和,形成密度为ρg/mL的溶液,下列表达式正确的是( )
A.饱和溶液的物质的量浓度为:![]() mol/L
mol/L
B.饱和溶液中溶质的质量分数为:![]() %
%
C.饱和溶液的体积为:![]() L
L
D.25℃时,A的溶解度为:![]() g
g
科目:高中化学 来源: 题型:
【题目】分子式为C5H11Cl的卤代烃,其分子中含有两个—CH3、两个—CH2—、一个![]() 和一个—Cl,它可能的结构有( )
和一个—Cl,它可能的结构有( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“最多”“最少”的说法中不正确的是( )。
A.在盐酸与氢氧化钠溶液的中和热测定的实验过程中,最少需要测定并记录温度的次数是3次
B.在硫酸铜晶体中结晶水含量测定的实验中,在实验过程中最少称量4次
C.在某有机物分子中含n个—CH2—,m个![]() ,a个—CH3,其余为羟基,则含羟基的个数最多为m - a + 2
,a个—CH3,其余为羟基,则含羟基的个数最多为m - a + 2
D.在有机物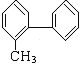 分子中处于同一平面内的碳原子数最多有13个
分子中处于同一平面内的碳原子数最多有13个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年又是一个奥运年,兴奋剂问题再次受到广泛关注。心酮胺是治疗心脏疾病的一种药物,是国际足联批准使用的药品,它具有如图所示结构筒式,下列关于心酮胺的描述,不正确的是( )
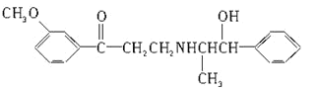
A.能够发生加成反应的官能团有两种
B.能够发生水解反应
C.当1mol心酮胺和H2发生加成反应时最多消耗7mol H2
D.能够与浓硝酸和浓硫酸的混合液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气可以作食品包装、灯泡等的填充气。一种实验室制备氮气的方法是:NH4Cl+NaNO2=NaCl+2H2O+N2↑ 。反应发生后即停止加热,反应仍可持续进行,直至反应完全。下列说法正确的是
A.该反应只有在低温下才能自发进行
B.NH4Cl的电子式: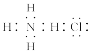
C.元素的电负性:Cl>O>H
D.①和②示意图表示的钠原子,电离出最外层一个电子所需要的能量:①>② ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种常见的短周期元素,可形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子具有相同的电子层结构,X离子比Y离子多一个电子层,试回答:
(1)X、Y、Z的单质的晶体分别属于_______晶体,________晶体,_________晶体。
(2)Z2Y2的电子式为_____,Z2Y2溶于水的化学方程式为_____
(3)XY3的水溶液与Z2Y2反应可生成一种具有漂白性的氧化剂H2Y2,其化学方程式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
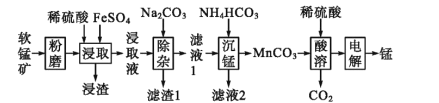
(1)写出“浸渣”中主要成分的用途 ________(写出两条)。
(2)滤渣1的主要成分是 ________(用化学式表示)
(3)经检测“浸取液”中无Fe2+,“浸取”时MnO 2发生反应的离子方程式为 ________。
(4)写出“沉锰”操作中发生反应的离子方程式:________。
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解,应采用 ______(填“阴”或“阳”)离子交换膜,阳极的电极反应式为________。
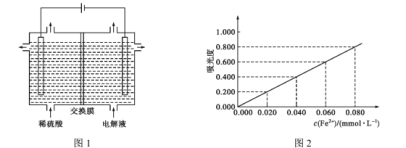
(6)为充分利用“滤渣1”,需测定滤渣中铝元素的含量,设计以下方案。
①将ag滤渣处理成xmL溶液。
②取少量①中溶液用EDTA滴定测得溶液中Fe3+ 、Al3+ 的浓度之和为ymmol·L-1 。
③另取少量①中溶液将Fe3+ 用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl- )还原为Fe2+,离子方程式为 ________;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中铝元素的质量分数为 _________(用含字母的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,气体密度不变
④恒温恒压时,充入惰性气体,平衡不移动
⑤加入催化剂,B的平衡转化率提高
A.①②B.②C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用![]() (熔点2045℃)和冰晶石(
(熔点2045℃)和冰晶石(![]() )混合熔融后电解制得。请回答下列问题:
)混合熔融后电解制得。请回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,其原因是__________,冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,请写出铝与V2O5在高温下反应的化学方程式:___________。
(2)将![]() 液和
液和![]() 溶液混合制取
溶液混合制取![]() 。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
(3)下列关于铝元素的叙述不正确的是__________(填序号)。
A.铝是人类最早使用的金属
B.镁铝合金既可完全溶于过量的盐酸,又可完全溶于过量的NaOH溶液
C.氢氧化铝是一种两性氢氧化物,既能溶于盐酸又能溶于NaOH溶液
D.铝是人体必需的微量元素之一,因此在生活中人们应尽量使用铝制炊具和餐具更有利于身体健康
(4)某工厂排放出有毒物质NOCl,它遇水就会生成![]() 。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的
。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的![]() 对人类健康会产生危害,为了降低水源中
对人类健康会产生危害,为了降低水源中![]() 的浓度,有研究人员建议在碱性条件下用铝粉将
的浓度,有研究人员建议在碱性条件下用铝粉将![]() 还原为N2,此时铝主要以
还原为N2,此时铝主要以![]() 的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的
的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的![]() 在标况下的体积约为_______L。
在标况下的体积约为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com