
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,气体密度不变
④恒温恒压时,充入惰性气体,平衡不移动
⑤加入催化剂,B的平衡转化率提高
A.①②B.②C.①③D.②④
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。(1)用甲烷制取氢气的两步反应的能量变化如下图所示:
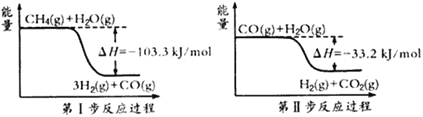
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
②第Ⅱ步反应为可逆反应。800℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则CO的平衡转化率为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为___________________,反应消耗1mol NaBH4时转移的电子数目为_______。
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
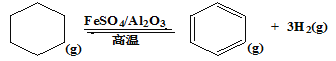
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=____________________(用含a、b的关系式表达)。
(4)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
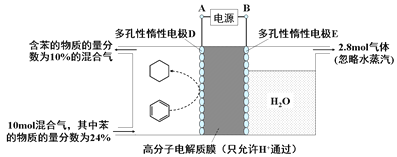
①实现有机物储氢的电极是________;
A.正极 | B.负极 | C.阴极 | D.阳极 |
其电极反应方程为:________________________。
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是_________。由表中数据可知,此装置的电流效率η=______________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡向_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是 ( )

A. X、Y、Z三种元素中,X的非金属性最强
B. 常压下X的单质的熔点比Z的低
C. Y的最高正化合价为+7
D. Y的氢化物的稳定性比Z的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
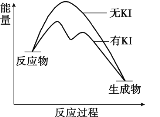
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 N乙烯基吡咯烷酮(NVP)和甲基丙烯酸 β羟乙基(HEMA)合成水凝胶材料高聚物A 具有较高的含水量,其路线如下图所示:
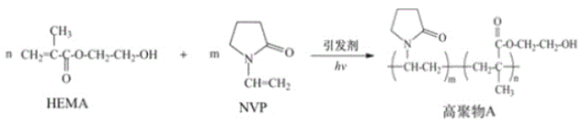
下列说法不正确的是
A.HEMA 的水解产物均可用作聚合反应的单体
B.高聚物A 因含有多个—OH 而具有良好的亲水性
C.HEMA 和 NVP 通过缩聚反应生成高聚物 A
D.若将高聚物A 与足量HOOC(CH2)4COOH 反应,可能通过形成新的酯基,进而交联形成网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=_____,醋酸的电离平衡常数Ka=______。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:
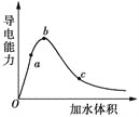
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是___。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_______c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | HCN |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=5.0×10-10 |
请回答下列问题:
①H2CO3的第二级电离平衡常数的表达式Ka2=_______。
②25℃时,向0.1molL-1的氨水中缓缓通入CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是___。
A.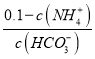 B.
B.![]() C.
C.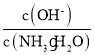 D.
D.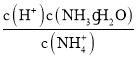
③向NaCN溶液中通入少量CO2气体,发生反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com