
【题目】工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
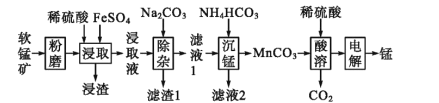
(1)写出“浸渣”中主要成分的用途 ________(写出两条)。
(2)滤渣1的主要成分是 ________(用化学式表示)
(3)经检测“浸取液”中无Fe2+,“浸取”时MnO 2发生反应的离子方程式为 ________。
(4)写出“沉锰”操作中发生反应的离子方程式:________。
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解,应采用 ______(填“阴”或“阳”)离子交换膜,阳极的电极反应式为________。
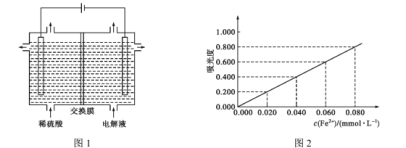
(6)为充分利用“滤渣1”,需测定滤渣中铝元素的含量,设计以下方案。
①将ag滤渣处理成xmL溶液。
②取少量①中溶液用EDTA滴定测得溶液中Fe3+ 、Al3+ 的浓度之和为ymmol·L-1 。
③另取少量①中溶液将Fe3+ 用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl- )还原为Fe2+,离子方程式为 ________;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中铝元素的质量分数为 _________(用含字母的表达式表示)。
【答案】制造玻璃、光导纤维; Al(OH)3; MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O; Mn2++2HCO3-=MnCO3↓+H2O+CO2↑; 阴; 2H2O-4e-=4H++O2↑; 2Fe3++2NH3OH+=2Fe2++4H++N2↑+2H2O; ![]() 。
。
【解析】
软锰矿制取金属锰的工艺流程图,结合软锰矿的成分及性质、加入的物质,判断浸取、除杂、沉锰、酸溶、电解等步骤发生的反应,可确定“浸渣”中主要成分为二氧化硅;根据吸光度与Fe2+的浓度关系图,确定吸光度为0.400时的c(Fe2+),再结合EDTA滴定,测得结果确定c(Al3+),从而求出样品中m(Al)及Al元素的质量分数。
(1)写出“浸渣”中主要成分为二氧化硅,所以用途为制造玻璃、光导纤维;
(2)浸取液中含有Al3+,加入碳酸钠,碳酸根和铝离子发生双水解,产生氢氧化铝沉淀,所以滤渣1的主要成分是Al(OH)3;
(3)经检测“浸取液”中无Fe2+,则在“浸取”过程中Fe3+与MnO 2发生了反应,离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)滤液1中主要含有硫酸锰,加入碳酸氢铵,发生反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;
(5)酸溶后的溶液中含有MnSO4,左侧是阳极,电极反应式为2H2O-4e-=4H++O2↑;右侧是阴极,电极反应式为Mn2++2e-=Mn,为维持交换膜两侧电解质溶液电荷守恒,且使电解生成Mn的反应持续进行,SO42-需要透过交换膜向左例移动,故交换膜是阴离子交换膜;
(6) ③盐酸羟胺在溶液中可完全电离出NH3OH+与Cl-,将Fe3+用盐酸羟胺还原为Fe2+,NH2OH被氧化生成N2,离子方程式为2Fe3++2NH3OH+=2Fe2++4H++N2↑+2H2O;
④由题图乙可知,吸光度为0.400时,溶液中c(Fe2+)=0.040mmolL-1,用EDTA标准溶液滴定测得溶液中Fe3+、Al3+的浓度之和为b mmolL-1,则有c(Al3+)=(b-0.04)mmolL-1=(b-0.04)×10-3molL-1,样品中Al元素的质量m(Al)=(b-0.04)x10-3molL-1×27g/mol=27a(b-0.04)×10-10g,故样品中A元素的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4 下列说法不正确的是( )
MnO2+Zn+2H2SO4 下列说法不正确的是( )
A.H2SO4氧化性大于MnO2B.①中析出16 g S时转移l mol电子
C.②反应电解时阴极上Zn2+先放电D.硫酸在该生产中可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25mL 0.1mol·L-1 NaOH溶液中,逐滴加入0.2mol·L-1 CH3COOH溶液,溶液pH的变化曲线如下图所示。下列分析中正确的是( )
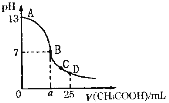
A.C点c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
B.B点的横坐标a=12.5
C.D点c(CH3COO—)+c(CH3COOH)=c(Na+)
D.曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为A·nH2O,其相对分子质量为M,在25℃时,ag晶体溶于bg水中即达饱和,形成密度为ρg/mL的溶液,下列表达式正确的是( )
A.饱和溶液的物质的量浓度为:![]() mol/L
mol/L
B.饱和溶液中溶质的质量分数为:![]() %
%
C.饱和溶液的体积为:![]() L
L
D.25℃时,A的溶解度为:![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图海水综合利用的工业流程图判断,下列说法正确的是
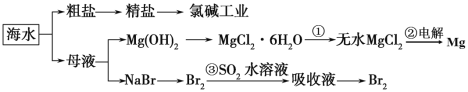
A.过程①中将MgCl2·6H2O灼烧即可制得无水MgCl2
B.在工业上可用电解MgCl2溶液的方法生产金属镁
C.过程③反应后溶液呈强酸性,故生产中需解决其对金属设备的腐蚀问题
D.氯碱工业生产中适当增加电流强度可增大电解反应的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g)![]() CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O![]() FeO++N2;则第二步为____________________(写化学方程式)。
FeO++N2;则第二步为____________________(写化学方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_________(填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)![]() 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
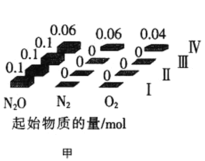
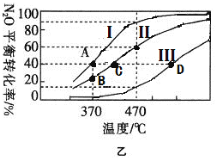
①该反应的△H_____0(填“>”或“<”)。
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为_________。B点对应的平衡常数k=________(保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是 _______________。
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应_________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
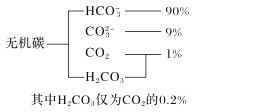
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________。已知春季海水pH=8.1,预测冬季海水碱性将会_______(填“增强”或“减弱”),理由是_________________。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________(填字母)。
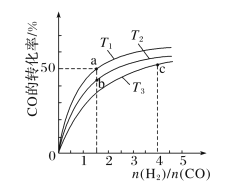
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
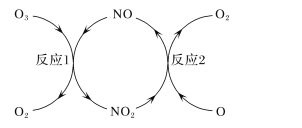
①NO的作用是_________________。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1 。
反应2:热化学方程式为____________________________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
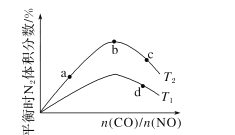
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3 ⑤HCl ⑥Al(OH)3
(1)pH值相同的③和⑤,分别用蒸馏水稀释至原来的![]() 倍和
倍和![]() 倍,稀释后两溶液的
倍,稀释后两溶液的![]() 值仍然相同,则
值仍然相同,则![]() ______
______![]() (填“<”或“>”或“=”)
(填“<”或“>”或“=”)
(2)室温下,![]() 值为11的①溶液中,由水电离出来的c(OH—)=______
值为11的①溶液中,由水电离出来的c(OH—)=______
(3)写出①溶液的电荷守恒:____________。
(4)写出⑥的酸式电离方程式:________________
(5)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________(用离子方程式解释)
(6)已知反应NH4++HCO3-+H2ONH3·H2O+H2CO3,该反应平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
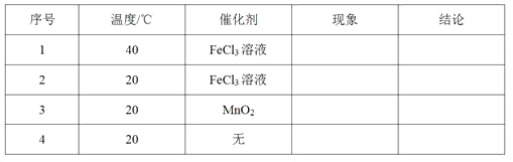
①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
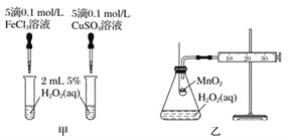
①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com