
【题目】N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g)![]() CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O![]() FeO++N2;则第二步为____________________(写化学方程式)。
FeO++N2;则第二步为____________________(写化学方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_________(填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)![]() 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
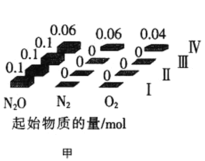
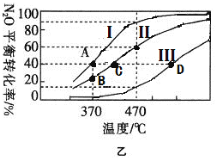
①该反应的△H_____0(填“>”或“<”)。
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为_________。B点对应的平衡常数k=________(保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是 _______________。
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应_________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
【答案】FeO++CO![]() Fe++CO2 大于 > 0.0005 mol·L-1·s-1 0.0044 D>C>A 向逆反应方向
Fe++CO2 大于 > 0.0005 mol·L-1·s-1 0.0044 D>C>A 向逆反应方向
【解析】
(1)将总反应减去第一步反应,可得第二步反应;第二步反应几乎不影响总反应达到平衡所用的时间,即第一步反应决定总反应的反应速率,则第一步反应的活化能大于第二步反应的活化能;
(2)①取同一条直线,分析温度对平衡的影响即可得到反应的热效应;
②v(O2)=![]() ,根据N2O的转化率可以计算出△n(O2),从而得v(O2);平衡常数只和温度有关,题中并未告知B点的容器体积,故需要通过计算A点的平衡常数;
,根据N2O的转化率可以计算出△n(O2),从而得v(O2);平衡常数只和温度有关,题中并未告知B点的容器体积,故需要通过计算A点的平衡常数;
③整个反应过程中,容器体积均不变,体系的总质量也不变,故体系的密度也不变,故分析370℃时,根据压强的影响判断出容器体积大小,从而可以比较各体系的密度大小;
④比较该温度下,容器IV中Qc和K的大小关系即可。
(1)将总反应减去第一步反应,可得第二步反应: FeO++CO![]() Fe++CO2;第二步反应几乎不影响总反应达到平衡所用的时间,即第一步反应决定总反应的反应速率,则第一步反应的活化能大于第二步反应的活化能;
Fe++CO2;第二步反应几乎不影响总反应达到平衡所用的时间,即第一步反应决定总反应的反应速率,则第一步反应的活化能大于第二步反应的活化能;
(2)①分析曲线I,温度升高,N2O的转化率增大,则该反应是吸热反应,即△H>0;
②容器I中,20s后反应达到平衡,则N2O的转化率为40%,即△n(N2O)=0.1mol×40%=0.04mol,则△n(O2)=0.02mol,v(O2)=![]() =0.0005mol·L-1·s-1;由于平衡常数只和温度有关,故B点的平衡常数和A点的平衡常数相同,A点,c(N2O)=
=0.0005mol·L-1·s-1;由于平衡常数只和温度有关,故B点的平衡常数和A点的平衡常数相同,A点,c(N2O)=![]() =0.03mol/L,c(N2)=
=0.03mol/L,c(N2)=![]() =0.02mol/L,c(O2)=
=0.02mol/L,c(O2)=![]() =0.01mol/L,则K=
=0.01mol/L,则K=![]() =
=![]() =0.0044;
=0.0044;
③温度相同时,转化率:I>II>III,则压强:I<II<III,故体积I>II>III,由于这三个容器中的体系的总质量相同,故密度:I<II<III,在整个反应中,体系的质量、体积都不变,故密度也不变,即D>C>A;
④容器IV中,起始时,c(N2O)=![]() =0.06mol/L,c(N2)=
=0.06mol/L,c(N2)= ![]() =0.06mol/L,c(O2)=
=0.06mol/L,c(O2)=![]() =0.04mol/L,则Qc=
=0.04mol/L,则Qc=![]() =
=![]() =0.04>K,则起始时反应向逆反应方向移动。
=0.04>K,则起始时反应向逆反应方向移动。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 46 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为 ( )
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A.+412 kJ·mol-1B.-412 kJ·mol-1
C.+236 kJ·mol-1D.-236 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年又是一个奥运年,兴奋剂问题再次受到广泛关注。心酮胺是治疗心脏疾病的一种药物,是国际足联批准使用的药品,它具有如图所示结构筒式,下列关于心酮胺的描述,不正确的是( )
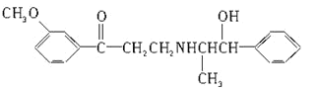
A.能够发生加成反应的官能团有两种
B.能够发生水解反应
C.当1mol心酮胺和H2发生加成反应时最多消耗7mol H2
D.能够与浓硝酸和浓硫酸的混合液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种常见的短周期元素,可形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子具有相同的电子层结构,X离子比Y离子多一个电子层,试回答:
(1)X、Y、Z的单质的晶体分别属于_______晶体,________晶体,_________晶体。
(2)Z2Y2的电子式为_____,Z2Y2溶于水的化学方程式为_____
(3)XY3的水溶液与Z2Y2反应可生成一种具有漂白性的氧化剂H2Y2,其化学方程式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
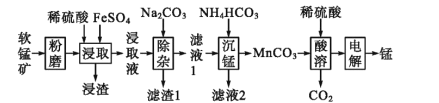
(1)写出“浸渣”中主要成分的用途 ________(写出两条)。
(2)滤渣1的主要成分是 ________(用化学式表示)
(3)经检测“浸取液”中无Fe2+,“浸取”时MnO 2发生反应的离子方程式为 ________。
(4)写出“沉锰”操作中发生反应的离子方程式:________。
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解,应采用 ______(填“阴”或“阳”)离子交换膜,阳极的电极反应式为________。
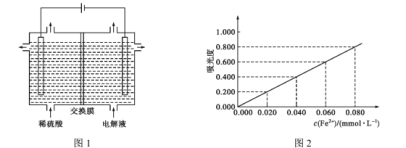
(6)为充分利用“滤渣1”,需测定滤渣中铝元素的含量,设计以下方案。
①将ag滤渣处理成xmL溶液。
②取少量①中溶液用EDTA滴定测得溶液中Fe3+ 、Al3+ 的浓度之和为ymmol·L-1 。
③另取少量①中溶液将Fe3+ 用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl- )还原为Fe2+,离子方程式为 ________;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中铝元素的质量分数为 _________(用含字母的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的前四周期元素。A元素的所有P能级都是半满状态,B元素的最外层电子数是核外电子总数的1/6,C元素是生活中使用非常广泛的金属元素,D元素的主族序数与周期数差值为4,E元素核外未成对电子数在本周期最多,F元素M能层所有能级都排满电子,N层只有一个电子。请回答下列问题:
(1)A元素的最高价氧化物对应水化物和它的氢化物可以形成一种盐,常温下该盐溶液中离子浓度由大到小的顺序为:_______________________。
(2)B、C、D的简单离子半径由大到小的顺序为_____________。
(3)C元素的氧化物与氢氧化钠溶液反应的离子方程式为____________。
(4)E元素核外有______种运动状态不同的电子。
(5)F元素的价电子排布式为______________。1mol [F(AH3)4]2+配合离子中所含σ键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,气体密度不变
④恒温恒压时,充入惰性气体,平衡不移动
⑤加入催化剂,B的平衡转化率提高
A.①②B.②C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
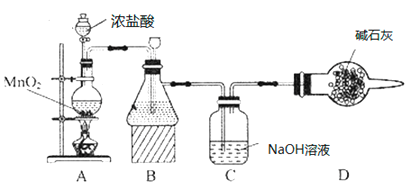
(1)该学习小组按如图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
已知:①饱和NaClO溶液pH为11;②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8。回答下列问题:
①装置B盛装的试剂是___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中C瓶溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的锥形瓶中发生反应的离子方程式为_________。
②滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1) N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为______。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-=2NO2-+H2O;2NO2+2OH-=NO3-+NO2-+H2O;
①下列措施能提高尾气中NO和NO2去除率的有______(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是______(填化学式);吸收后排放的尾气中含量较高的氮氧化物是______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com