
【题目】A、B、C、D、E、F是原子序数依次增大的前四周期元素。A元素的所有P能级都是半满状态,B元素的最外层电子数是核外电子总数的1/6,C元素是生活中使用非常广泛的金属元素,D元素的主族序数与周期数差值为4,E元素核外未成对电子数在本周期最多,F元素M能层所有能级都排满电子,N层只有一个电子。请回答下列问题:
(1)A元素的最高价氧化物对应水化物和它的氢化物可以形成一种盐,常温下该盐溶液中离子浓度由大到小的顺序为:_______________________。
(2)B、C、D的简单离子半径由大到小的顺序为_____________。
(3)C元素的氧化物与氢氧化钠溶液反应的离子方程式为____________。
(4)E元素核外有______种运动状态不同的电子。
(5)F元素的价电子排布式为______________。1mol [F(AH3)4]2+配合离子中所含σ键的数目为___________。
【答案】c((NO3-)>c(NH4+)>c(H+)>c(OH-) Cl- >Mg2+> Al3+ Al2O3+2OH-=2AlO2-+H2O 24 3d104s1 16NA
【解析】
A元素的所有P能级都是半满状态,则A的核外电子排布为1s22s22p3,即A为N;B元素的最外层电子数是核外电子总数的1/6,设B元素的最外层电子数为x,由于B的原子序数比A大,则有![]() =
=![]() ,解得x=2,则B的核外电子排布为2、8、2,故B为Mg;D元素的主族序数与周期数差值为4,且D的原子序数比B大,则D位于第三或第四周期,若D位于第四周期,则D的族序数为8,与“主族”矛盾,故D为与第三周期,其主族序数为7,则D为Cl;C元素是生活中使用非常广泛的金属元素,且C的原子序数在B、D之间,故C为Al; E的原子序数大于D(Cl),且E元素核外未成对电子数在本周期最多,则E位于第四周期,其核外电子排布为1s22s22p63s23p63d54s1,即E为Cr;F元素M能层所有能级都排满电子,N层只有一个电子,则F的核外电子排布为1s22s22p63s23p63d104s1,则F为Cu;综上所述,A为N,B为Mg,C为Al,D为Cl,E为Cr,F为Cu。
,解得x=2,则B的核外电子排布为2、8、2,故B为Mg;D元素的主族序数与周期数差值为4,且D的原子序数比B大,则D位于第三或第四周期,若D位于第四周期,则D的族序数为8,与“主族”矛盾,故D为与第三周期,其主族序数为7,则D为Cl;C元素是生活中使用非常广泛的金属元素,且C的原子序数在B、D之间,故C为Al; E的原子序数大于D(Cl),且E元素核外未成对电子数在本周期最多,则E位于第四周期,其核外电子排布为1s22s22p63s23p63d54s1,即E为Cr;F元素M能层所有能级都排满电子,N层只有一个电子,则F的核外电子排布为1s22s22p63s23p63d104s1,则F为Cu;综上所述,A为N,B为Mg,C为Al,D为Cl,E为Cr,F为Cu。
经分析,A为N,B为Mg,C为Al,D为Cl,E为Cr,F为Cu,
(1)A元素的最高价氧化物对应水化物HNO3和它的氢化物NH3形成的盐为NH4NO3,是强酸弱碱盐,其水溶液中离子浓度由大到小为:c((NO3-)>c(NH4+)>c(H+)>c(OH-);
(2)B、C、D的简单离子分别为Mg2+、Al3+、Cl-,则离子半径由大到小为:Cl->Mg2+> Al3+;
(3)C元素的氧化物Al2O3和NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
(4)E为Cr,是24号元素,核外电子数为24,则其核外有24种运动状态不同的电子;
(5)F为Cu,其价电子排布为3d104s1;1个[F(AH3)4]2+即[Cu(NH3)4]2+中含有16个σ键,则1mol该离子含有16NA个σ键。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
A.原子电子层数:A<BB.气态氢化物的稳定性:B<E
C.简单离子半径:E<DD.最高价氧化物对应的水化物碱性:C<D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数的叙述正确的是( )
A.17g OH—含有9×6.02×1023个电子
B.标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
C.106g碳酸钠溶液中含有6.02×1023个阴离子
D.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图示实验的描述正确的是
A.图1所示的实验:钢闸门连在外接电源的负极上可以对其进行保护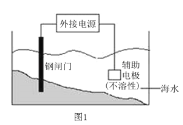
B.图2所示的实验:用NaOH溶液滴定盐酸![]()
C.图3所示的实验:用浓硫酸和NaOH溶液反应测定中和热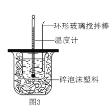
D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)![]() N2O4(g)正反应是吸热反应
N2O4(g)正反应是吸热反应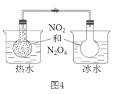
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g)![]() CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O![]() FeO++N2;则第二步为____________________(写化学方程式)。
FeO++N2;则第二步为____________________(写化学方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_________(填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)![]() 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
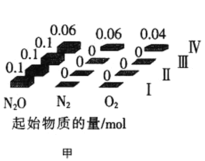
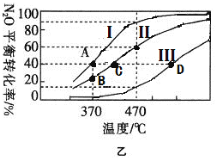
①该反应的△H_____0(填“>”或“<”)。
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为_________。B点对应的平衡常数k=________(保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是 _______________。
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应_________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准浓度氢氧化钠的溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③酸式滴定用蒸馏水洗净后,未用盐酸润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱式滴定管读数时,俯视刻度线
A.①④B.①③C.②③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka、Kb、Kw、Kh、Ksp分别表示弱酸的电离平衡常数、弱碱的电离平衡常数,水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11
(1)有关上述常数的说法正确的是__________。
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的Ksp都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,1.0 mol·L-1 HF溶液的pH约等于__________(已知lg2≈0.3)。将浓度相等的HF与NaF溶液等体积混合,判断溶液呈_______(填“酸”、“碱”或“中”)性,并结合有关数据解释原因:_____________。
(3)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:A.NH4Cl,B.NH4SCN,C.CH3COONH4,D.NH4HCO3。回答下列问题:
①试推断NH4HCO3溶液的pH__________7(填“>”、“<”或“=”);
②将四种溶液按NH4+浓度由大到小的顺序排列是:__________(填序号)。
③NH4SCN溶液中所有离子浓度由大到小的顺序为_________。
(4)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)![]() Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-50℃时液氨中存在着下列平衡:2NH3(液)![]() NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
A. 离子积为1.0×10-15
B. 离子积为1.0×10-30
C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大
D. 向液氨中加入NH4Cl,c(NH4+)增大,离子积的数值也随之增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com