
【题目】下列有关阿伏加德罗常数的叙述正确的是( )
A.17g OH—含有9×6.02×1023个电子
B.标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
C.106g碳酸钠溶液中含有6.02×1023个阴离子
D.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
【答案】B
【解析】
A. 一个![]() 含有8+1+1=10个电子,那么
含有8+1+1=10个电子,那么![]() 个
个![]() 含有
含有![]() 个电子,已知m(
个电子,已知m(![]() )=17g,那么
)=17g,那么![]() ,即
,即![]() 个
个![]() ,所以电子数为10
,所以电子数为10![]() ,即为10×6.02×1023个电子,A错误;
,即为10×6.02×1023个电子,A错误;
B. 标准状况下,甲醛为气体,0.5×6.02×1023个甲醛分子即为0.5mol,能使用![]() ,B正确;
,B正确;
C. ![]() ,在水溶液中
,在水溶液中![]() 发生水解,
发生水解,![]() ,若有X个
,若有X个![]() 发生水解,就会生成X个
发生水解,就会生成X个![]() 和X个
和X个![]() ,所以阴离子大于6.02×1023个阴离子,C错误;
,所以阴离子大于6.02×1023个阴离子,C错误;
D. 浓盐酸与足量二氧化锰反应过程中,浓盐酸不仅会挥发一部分而且在反应一段时间后浓盐酸会变成稀盐酸,就不会和二氧化锰反应,因此4mol HCl的HCl并不能全部参加反应,生成的Cl2小于22.4L,D错误;
答案选B。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 ( )
2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 ( )
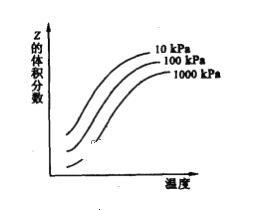
A.X、Y、Z均为气态
B.X和Y中只有一种为气态,Z为气态
C.上述该反应的正反应为放热反应
D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L-1
D.2 min末时A的消耗浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
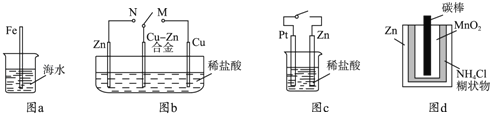
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年又是一个奥运年,兴奋剂问题再次受到广泛关注。心酮胺是治疗心脏疾病的一种药物,是国际足联批准使用的药品,它具有如图所示结构筒式,下列关于心酮胺的描述,不正确的是( )
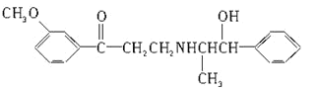
A.能够发生加成反应的官能团有两种
B.能够发生水解反应
C.当1mol心酮胺和H2发生加成反应时最多消耗7mol H2
D.能够与浓硝酸和浓硫酸的混合液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.等物质的量的Ba(OH)2与KAl(SO4)2·12H2O溶液混合:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种常见的短周期元素,可形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子具有相同的电子层结构,X离子比Y离子多一个电子层,试回答:
(1)X、Y、Z的单质的晶体分别属于_______晶体,________晶体,_________晶体。
(2)Z2Y2的电子式为_____,Z2Y2溶于水的化学方程式为_____
(3)XY3的水溶液与Z2Y2反应可生成一种具有漂白性的氧化剂H2Y2,其化学方程式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的前四周期元素。A元素的所有P能级都是半满状态,B元素的最外层电子数是核外电子总数的1/6,C元素是生活中使用非常广泛的金属元素,D元素的主族序数与周期数差值为4,E元素核外未成对电子数在本周期最多,F元素M能层所有能级都排满电子,N层只有一个电子。请回答下列问题:
(1)A元素的最高价氧化物对应水化物和它的氢化物可以形成一种盐,常温下该盐溶液中离子浓度由大到小的顺序为:_______________________。
(2)B、C、D的简单离子半径由大到小的顺序为_____________。
(3)C元素的氧化物与氢氧化钠溶液反应的离子方程式为____________。
(4)E元素核外有______种运动状态不同的电子。
(5)F元素的价电子排布式为______________。1mol [F(AH3)4]2+配合离子中所含σ键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
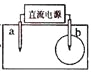
A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com