
【题目】如图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 ( )
2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 ( )
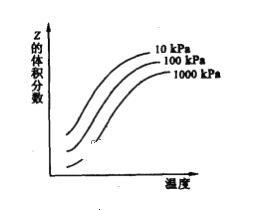
A.X、Y、Z均为气态
B.X和Y中只有一种为气态,Z为气态
C.上述该反应的正反应为放热反应
D.上述反应的逆反应的ΔH>0
【答案】B
【解析】
图象可以看出,升高温度,Z的体积分数增大,说明升高温度平衡向正反应方向移动,则正反应吸热,增大压强Z的体积分数减小,说明增大压强平衡向逆反应方向移动,根据物质的聚集状态判断化学计量数关系。
A. 增大压强,Z的体积分数减小,说明增大压强平衡向逆反应方向移动,说明气体反应物的化学计量数之和小于生成物的化学计量数,则X、Y中至少有一种不是气体,故A错误;
B. 增大压强,Z的体积分数减小,说明增大压强平衡向逆反应方向移动,说明气体反应物的化学计量数之和小于生成物的化学计量数,则X和Y中只有一种为气态,Z为气态,故B正确;
C. 升高温度,Z的体积分数增大,说明升高温度平衡向正反应方向移动,则正反应吸热反应,故C错误;
D. 正反应吸热,则逆反应放热,所以△H<0,故D错误;
答案选B。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】近年来,随着人类社会的快速发展,环境污染日益严重,而环境污染中的很多问题是由于氮磷富集化引起的,所以如何降低水体中的氮磷含量问题受到广泛关注。目前有两种较为有效的氨氮废水处理方法。
I.化学沉淀法
利用了Mg2+与PO43-与氨氮生成MgNH4PO46H2O沉淀以达到去除氨氮的效果。
已知:磷在pH=8-10时主要存在形式为HPO42-
Ksp(MgNH4PO46H2O)=2.5×10-13
(1)请写出pH=8时,化学沉淀法去除NH4+的离子方程式为_。
(2)氨氮去除率与含磷微粒浓度随pH变化如图1所示,已知:Ksp[Mg3(PO4)2]=6.3×10-26,请解释pH>10时氨氮去除率随pH变化的原因:__。

II.光催化法
(3)光催化降解过程中形成的羟基自由基(·OH)和超氧离子(·O2-)具有光催化能力,催化原理如图2所示。请写出NO3-转化为无毒物质的电极反应式:__。

(4)经过上述反应后,仍有NH4+残留,探究其去除条件。
①温度对氨氮去除率影响如图3所示。温度升高,氨氮去除率变化的可能原因是:__;__(请写出两条)。

②选取TiO2作为催化剂,已知:TiO2在酸性条件下带正电,碱性条件下带负电。请在图4中画出pH=5时,氨氮去除率变化曲线_____。

(5)为测定处理后废水中(含少量游离酸)残留NH4+浓度,可选用甲醛-滴定法进行测定。取20mL的处理后水样,以酚酞为指示剂,用0.0100mol/LNaOH滴定至酚酞变红,此时溶液中游离酸被完全消耗,记下消耗NaOH的体积V1mL;然后另取同样体积水样,加入甲醛,再加入2-3滴酚酞指示剂,静置5min,发生反应:6HCHO+4NH4+=(CH2)6N4H++6H2O+3H+,继续用NaOH滴定,发生反应:(CH2)6N4H++OH-=(CH2)6N4+H2O;H++OH-=H2O。滴定至终点,记录消耗NaOH的体积V2mL,水样中残留NH4+浓度为__mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标况下672mL气体。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是( )
A.336mLB.168mLC.224mLD.112mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物A:CH2=CH2、 B:![]() 、 C:CH3COOH
、 C:CH3COOH
(1)写出化合物A、C中官能团的名称______、_____;
(2)3种化合物中能使溴的四氯化碳溶液褪色的是_____(写名称);反应的化学方程式为:________________;具有特殊气味、常做有机溶剂的是____(写结构简式)。
(3)3种化合物中能与乙醇发生酯化反应的是______(写名称);反应的化学方程式为:____________;反应类型为:___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到实验目的的是
选项 | 实验目的 | 操作 |
A | 取20.00 mL盐酸 | 在25 mL酸式滴定管中装入盐酸。调整初始读数为5.00 mL后,将剩余盐酸全部放入锥形瓶中 |
B | 测量饱和Na2CO3溶液的pH值 | 用蒸馏水湿润pH试纸,放入Na2CO3溶液中,观察pH试纸颜色,并与比色卡对比,读出pH值 |
C | 制取纯净的FeCl 3固体 | 加热蒸干FeCl3溶液 |
D | 验证Ksp[Cu(OH)2]< Ksp[Mg(OH)2] | 将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol/L CuSO4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl与NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和氨水反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
A.原子电子层数:A<BB.气态氢化物的稳定性:B<E
C.简单离子半径:E<DD.最高价氧化物对应的水化物碱性:C<D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数的叙述正确的是( )
A.17g OH—含有9×6.02×1023个电子
B.标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
C.106g碳酸钠溶液中含有6.02×1023个阴离子
D.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com