
【题目】近年来,随着人类社会的快速发展,环境污染日益严重,而环境污染中的很多问题是由于氮磷富集化引起的,所以如何降低水体中的氮磷含量问题受到广泛关注。目前有两种较为有效的氨氮废水处理方法。
I.化学沉淀法
利用了Mg2+与PO43-与氨氮生成MgNH4PO46H2O沉淀以达到去除氨氮的效果。
已知:磷在pH=8-10时主要存在形式为HPO42-
Ksp(MgNH4PO46H2O)=2.5×10-13
(1)请写出pH=8时,化学沉淀法去除NH4+的离子方程式为_。
(2)氨氮去除率与含磷微粒浓度随pH变化如图1所示,已知:Ksp[Mg3(PO4)2]=6.3×10-26,请解释pH>10时氨氮去除率随pH变化的原因:__。

II.光催化法
(3)光催化降解过程中形成的羟基自由基(·OH)和超氧离子(·O2-)具有光催化能力,催化原理如图2所示。请写出NO3-转化为无毒物质的电极反应式:__。

(4)经过上述反应后,仍有NH4+残留,探究其去除条件。
①温度对氨氮去除率影响如图3所示。温度升高,氨氮去除率变化的可能原因是:__;__(请写出两条)。

②选取TiO2作为催化剂,已知:TiO2在酸性条件下带正电,碱性条件下带负电。请在图4中画出pH=5时,氨氮去除率变化曲线_____。

(5)为测定处理后废水中(含少量游离酸)残留NH4+浓度,可选用甲醛-滴定法进行测定。取20mL的处理后水样,以酚酞为指示剂,用0.0100mol/LNaOH滴定至酚酞变红,此时溶液中游离酸被完全消耗,记下消耗NaOH的体积V1mL;然后另取同样体积水样,加入甲醛,再加入2-3滴酚酞指示剂,静置5min,发生反应:6HCHO+4NH4+=(CH2)6N4H++6H2O+3H+,继续用NaOH滴定,发生反应:(CH2)6N4H++OH-=(CH2)6N4+H2O;H++OH-=H2O。滴定至终点,记录消耗NaOH的体积V2mL,水样中残留NH4+浓度为__mol/L。
【答案】Mg2++HPO42-+NH4++6H2O=MgNH4PO46H2O↓+H+ pH>10时NH4+与OH-反应生成NH3而挥发,Mg2+与PO43-反应生成Mg3(PO4)2沉淀,使氨氮去除率降低 2NO3-+12H++6e-=N2↑+6H2O 温度升高羟基自由基(·OH)和超氧离子(·O2-)的运动速率加快,羟基自由基(·OH)和超氧离子(·O2-)活性增大 温度升高羟基自由基(·OH)和超氧离子(·O2-)的形成速率增大,温度升高反应速率加快 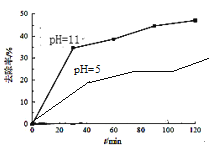
![]()
【解析】
(1)pH=8时,磷主要以HPO42-的形式存在,则应为Mg2+、HPO42-、NH4+发生反应,生成MgNH4PO46H2O沉淀。
(2) pH>10时,磷主要以PO43-的形式存在,从Ksp[Mg3(PO4)2]=6.3×10-26看,易生成Mg3(PO4)2沉淀,氨氮去除率降低,则表明NH4+与碱发生了反应。
(3)从图中可以看出,NO3-在H+存在的环境中得电子,生成N2等。
(4)①温度升高,氨氮去除率变化的可能原因是从温度对羟基自由基(·OH)和超氧离子(·O2-)的影响进行分析。
②依信息:TiO2在酸性条件下带正电,碱性条件下带负电。则在pH=5时,TiO2带正电,吸引NH4+的能力差,氨氮去除率比pH=11时要小。
(5)依题意,溶液中剩余的H++OH-=H2O,4NH4+——(CH2)6N4H++3H+——4OH-
代入数据即可求出水样中残留NH4+浓度。
(1)pH=8时,磷主要以HPO42-的形式存在,则应为Mg2+、HPO42-、NH4+发生反应,生成MgNH4PO46H2O沉淀,则反应的离子方程式为Mg2++HPO42-+NH4++6H2O=MgNH4PO46H2O↓+H+。答案为:Mg2++HPO42-+NH4++6H2O=MgNH4PO46H2O↓+H+;
(2) pH>10时,磷主要以PO43-的形式存在,由Ksp[Mg3(PO4)2]=6.3×10-26可知,此时PO43-易生成Mg3(PO4)2沉淀,从而使氨氮去除率降低,此时应发生NH4+与OH-的反应。从而得出pH>10时氨氮去除率随pH变化的原因是pH>10时NH4+与OH-反应生成NH3而挥发,Mg2+与PO43-反应生成Mg3(PO4)2沉淀,使氨氮去除率降低。答案为:pH>10时NH4+与OH-反应生成NH3而挥发,Mg2+与PO43-反应生成Mg3(PO4)2沉淀,使氨氮去除率降低;
(3)从图中可以看出,NO3-在H+存在的环境中得电子,生成N2等,电极反应式为2NO3-+12H++6e-=N2↑+6H2O。答案为:2NO3-+12H++6e-=N2↑+6H2O;
(4)①温度升高,氨氮去除率变化的可能原因是温度升高羟基自由基(·OH)和超氧离子(·O2-)的运动速率加快,羟基自由基(·OH)和超氧离子(·O2-)活性增大;温度升高羟基自由基(·OH)和超氧离子(·O2-)的形成速率增大,温度升高反应速率加快。答案为:温度升高羟基自由基(·OH)和超氧离子(·O2-)的运动速率加快,羟基自由基(·OH)和超氧离子(·O2-)活性增大;温度升高羟基自由基(·OH)和超氧离子(·O2-)的形成速率增大,温度升高反应速率加快;
②依信息:TiO2在酸性条件下带正电,碱性条件下带负电。则在pH=5时,TiO2带正电,吸引NH4+的能力差,氨氮去除率比pH=11时要小。则pH=5时,氨氮去除率变化曲线为:
 答案为:
答案为: ;
;
(5)依题意,溶液中剩余的H++OH-=H2O,4NH4+——(CH2)6N4H++3H+——4OH-
则n(NH4+)=0.01mol/L×V2×10-3L-0.01mol/L×V1×10-3L=0.01(V2-V1)×10-3mol,
水样中残留NH4+浓度为![]() =
=![]() mol/L。答案为:
mol/L。答案为:![]() ;
;


科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液![]() A和食盐的饱和溶液
A和食盐的饱和溶液![]() 悬浊液
悬浊液![]() 晶体
晶体![]() 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A(g)+B(g)![]() 2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )
2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )

A.该反应是吸热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1时若由a点达到平衡,可以采取增大压强的方法
D.c点v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,各物质浓度随时间变化的关系如图所示:

计算该反应的平衡常数K=________。反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol·L-1。第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1________w2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
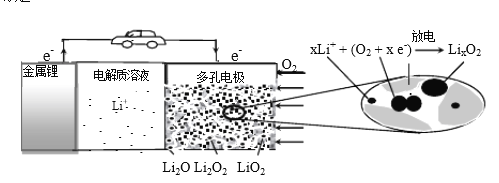
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )

①X、Y的最高价氧化物的水化物酸性为Y<X;②Y、Z的气态氢化物的稳定性Y<Z;③W的单质常温下呈液态,一定条件下可与铁粉反应;④W的原子序数比Z大9。
A. 只有③ B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某个容积为2 L的密闭容器内,在T℃时按下图1所示发生反应:

mA(g)+nB(g)![]() pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
(1)根据图1所示,反应开始至达到平衡时,用D表示该反应速率为____________ mol/(L·min);方程式中m:n:p:q =________________
(2)该反应的化学平衡常数K为_________________(保留至一位小数);
(3)下列措施能增大B的转化率的是 ( )
A.升高温度 B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g) D.将容器的容积增大为原来的2倍
E. 保持体积不变通入1mol A
(4)能判断该反应已经达到化学平衡状态的是( )
A.恒容恒温时容器中气体压强保持不变
B.混合气体中D浓度不变
C.v(A)正 = v(A)逆
D.恒容时容器中气体密度不变
(5)反应达到平衡后,第7 min时,改变条件,在第9min达到新的平衡,在图2上作出第7 min至第15 min(作在答题纸上):下列情况下,D浓度变化图像
①若降低温度且平衡时D物质的量变化了0.4 mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮存在下列平衡2NO2 (g) ![]() N2O4(g);△H<0。在测定NO2 相对分子质量时,下列条件中较为适宜的是
N2O4(g);△H<0。在测定NO2 相对分子质量时,下列条件中较为适宜的是
A.温度130℃,压强3.03×105paB.温度25℃, 压强1.01×105pa
C.温度130℃,压强5.05×104paD.温度0℃, 压强5.05×104pa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 ( )
2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 ( )
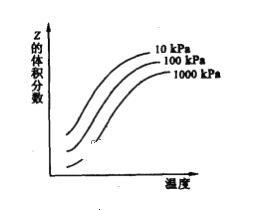
A.X、Y、Z均为气态
B.X和Y中只有一种为气态,Z为气态
C.上述该反应的正反应为放热反应
D.上述反应的逆反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com