
【题目】对下列图示实验的描述正确的是
A.图1所示的实验:钢闸门连在外接电源的负极上可以对其进行保护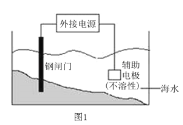
B.图2所示的实验:用NaOH溶液滴定盐酸![]()
C.图3所示的实验:用浓硫酸和NaOH溶液反应测定中和热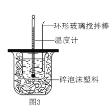
D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)![]() N2O4(g)正反应是吸热反应
N2O4(g)正反应是吸热反应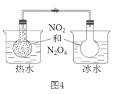
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ 热量
C.氢气的燃烧热为241.8kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
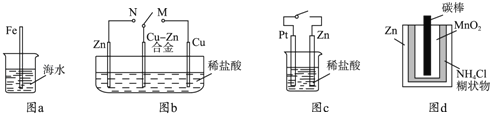
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.等物质的量的Ba(OH)2与KAl(SO4)2·12H2O溶液混合:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种常见的短周期元素,可形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子具有相同的电子层结构,X离子比Y离子多一个电子层,试回答:
(1)X、Y、Z的单质的晶体分别属于_______晶体,________晶体,_________晶体。
(2)Z2Y2的电子式为_____,Z2Y2溶于水的化学方程式为_____
(3)XY3的水溶液与Z2Y2反应可生成一种具有漂白性的氧化剂H2Y2,其化学方程式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的前四周期元素。A元素的所有P能级都是半满状态,B元素的最外层电子数是核外电子总数的1/6,C元素是生活中使用非常广泛的金属元素,D元素的主族序数与周期数差值为4,E元素核外未成对电子数在本周期最多,F元素M能层所有能级都排满电子,N层只有一个电子。请回答下列问题:
(1)A元素的最高价氧化物对应水化物和它的氢化物可以形成一种盐,常温下该盐溶液中离子浓度由大到小的顺序为:_______________________。
(2)B、C、D的简单离子半径由大到小的顺序为_____________。
(3)C元素的氧化物与氢氧化钠溶液反应的离子方程式为____________。
(4)E元素核外有______种运动状态不同的电子。
(5)F元素的价电子排布式为______________。1mol [F(AH3)4]2+配合离子中所含σ键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4HC2O4-+H+ Ka1;HC2O4-C2O42-+H+ Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4—、C2O42三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是( )
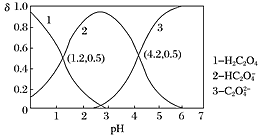
A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH)+c(H2C2O4)
B.pH=2.7的溶液中: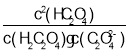 =1000
=1000
C.向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
D.将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com