
【题目】已知Ka、Kb、Kw、Kh、Ksp分别表示弱酸的电离平衡常数、弱碱的电离平衡常数,水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11
(1)有关上述常数的说法正确的是__________。
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的Ksp都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,1.0 mol·L-1 HF溶液的pH约等于__________(已知lg2≈0.3)。将浓度相等的HF与NaF溶液等体积混合,判断溶液呈_______(填“酸”、“碱”或“中”)性,并结合有关数据解释原因:_____________。
(3)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:A.NH4Cl,B.NH4SCN,C.CH3COONH4,D.NH4HCO3。回答下列问题:
①试推断NH4HCO3溶液的pH__________7(填“>”、“<”或“=”);
②将四种溶液按NH4+浓度由大到小的顺序排列是:__________(填序号)。
③NH4SCN溶液中所有离子浓度由大到小的顺序为_________。
(4)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)![]() Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
【答案】ad 1.7 酸 HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=2.5×10-9,所以HF电离程度大于NaF的水解程度,溶液显酸性 > A>B>C>D c(SCN-)> c(NH4+)> c(H+)> c(OH-) ![]() 能
能
【解析】
(1)a. 平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以它们都能反映一定条件下对应变化进行的程度,a正确;
b. 难溶电解质Ca(OH)2的Ksp随温度的升高而减小,b错误;
c. 电离平衡常数只与温度有关,温度相同电离平衡常数相同,c错误;
d. 一定温度下,在CH3COONa溶液中, ,所以KW=KaKh,d正确;故答案为:ad;
,所以KW=KaKh,d正确;故答案为:ad;
(2)25℃时,1.0 mol·L-1 HF溶液中,Ka(HF)= ,c(H+)=2.0×10-2,pH
,c(H+)=2.0×10-2,pH![]() ,HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=2.5×10-9,所以HF电离程度大于NaF的水解程度,溶液呈酸性,故答案为:
,HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=2.5×10-9,所以HF电离程度大于NaF的水解程度,溶液呈酸性,故答案为:![]() 酸; HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=0.25×10-10,所以HF电离程度大于NaF的水解程度,溶液显酸性;
酸; HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=0.25×10-10,所以HF电离程度大于NaF的水解程度,溶液显酸性;
(3)①已知CH3COONH4溶液为中性,说明CH3COO-和NH4+水解程度相同,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,说明酸性:CH3COOH>H2CO3,越弱越水解,可知HCO3-水解程度大于NH4+水解程度,所以NH4HCO3溶液显碱性,pH>7;故答案为:>;
②根据电离平衡常数可知,酸性:HSCN> CH3COOH>H2CO3,越弱越水解,所以四种溶液按NH4+浓度由大到小的顺序:A>B>C>D;故答案为:A>B>C>D;
③酸性:HSCN> CH3COOH ,CH3COO-和NH4+水解程度相同,所以NH4+水解程度大于SCN-水解程度,NH4SCN溶液显酸性,其所有离子浓度由大到小的顺序为:c(SCN-)> c(NH4+)> c(H+)> c(OH-);故答案为:c(SCN-)> c(NH4+)> c(H+)> c(OH-);
(4)在25℃时,平衡常数K=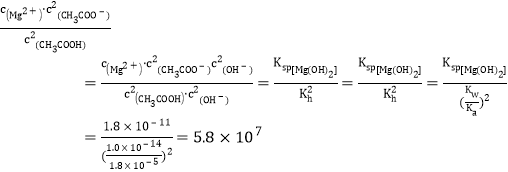 ,据此推断Mg(OH)2能溶解于醋酸,故答案为:
,据此推断Mg(OH)2能溶解于醋酸,故答案为:![]() ;能。
;能。


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
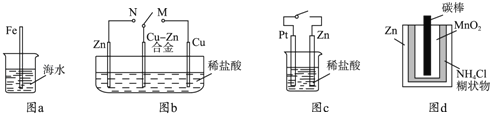
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的前四周期元素。A元素的所有P能级都是半满状态,B元素的最外层电子数是核外电子总数的1/6,C元素是生活中使用非常广泛的金属元素,D元素的主族序数与周期数差值为4,E元素核外未成对电子数在本周期最多,F元素M能层所有能级都排满电子,N层只有一个电子。请回答下列问题:
(1)A元素的最高价氧化物对应水化物和它的氢化物可以形成一种盐,常温下该盐溶液中离子浓度由大到小的顺序为:_______________________。
(2)B、C、D的简单离子半径由大到小的顺序为_____________。
(3)C元素的氧化物与氢氧化钠溶液反应的离子方程式为____________。
(4)E元素核外有______种运动状态不同的电子。
(5)F元素的价电子排布式为______________。1mol [F(AH3)4]2+配合离子中所含σ键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4HC2O4-+H+ Ka1;HC2O4-C2O42-+H+ Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4—、C2O42三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是( )
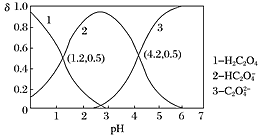
A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH)+c(H2C2O4)
B.pH=2.7的溶液中: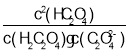 =1000
=1000
C.向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
D.将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
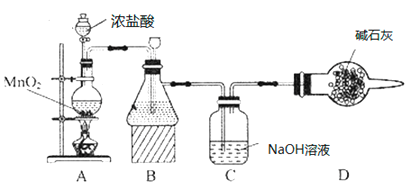
(1)该学习小组按如图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
已知:①饱和NaClO溶液pH为11;②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8。回答下列问题:
①装置B盛装的试剂是___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中C瓶溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的锥形瓶中发生反应的离子方程式为_________。
②滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题。
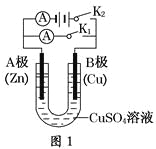
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
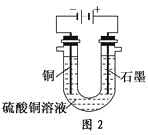
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
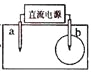
A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com