
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
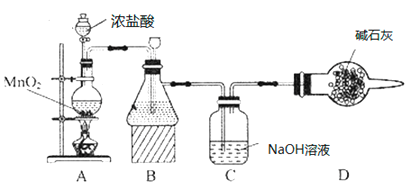
(1)该学习小组按如图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
已知:①饱和NaClO溶液pH为11;②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8。回答下列问题:
①装置B盛装的试剂是___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中C瓶溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的锥形瓶中发生反应的离子方程式为_________。
②滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
【答案】饱和食盐水 MnO2+2Cl-+4H+![]() Cl2↑+Mn2++2H2O NaClO、NaOH 溶液中存在平衡Cl2+H2O
Cl2↑+Mn2++2H2O NaClO、NaOH 溶液中存在平衡Cl2+H2O![]() HCl+HClO,HCO3—消耗H+,使平衡右移,HClO浓度增大 ClO—+2I—+2H+=I2+Cl—+H2O 当滴入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟不变色 4.47
HCl+HClO,HCO3—消耗H+,使平衡右移,HClO浓度增大 ClO—+2I—+2H+=I2+Cl—+H2O 当滴入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟不变色 4.47
【解析】
(1) 装置A中二氧化锰固体和浓盐酸反应生成氯气,氯气中含氯化氢气体,通过装置B中饱和食盐水除去氯化氢,通过装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠,通过碳酸氢钠溶液,氯气和水反应生成的盐酸和碳酸氢钠反应,促进氯气和水反应正向进行次氯酸浓度增大,最后通过碱石灰吸收多余氯气;
③D瓶溶液中石蕊立即褪色的原因是氯气和水反应生成的盐酸和碳酸氢钠反应,促进氯气和水反应正向进行次氯酸浓度增大;
(2)①取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,次氯酸钠在酸溶液中氧化碘化钾生成碘单质;
②淀粉遇碘变蓝;
③ClO-+2I-+2H+=I2+Cl-+H2O、I2+2S2O32-═2I-+S4O62-,ClO-~I2~2S2O32-,以此计算C瓶溶液中NaClO的含量。
(1)根据分析,B中盛装饱和食盐水,用来吸收氯气中的氯化氢气体,装置A中发生反应的离子方程式为MnO2+2Cl-+4H+![]() Cl2↑+Mn2++2H2O;
Cl2↑+Mn2++2H2O;
②氯气和装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠,C瓶溶液的溶质是NaClO、NaCl、NaOH;
③D瓶溶液中石蕊立即褪色的原因是:溶液中存在平衡Cl2+H2O![]() HCl+HClO,HCO3—消耗H+,使平衡右移,HClO浓度增大;
HCl+HClO,HCO3—消耗H+,使平衡右移,HClO浓度增大;
(2)①步骤I的C瓶中反应的离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O;
②通常选用淀粉溶液作指示剂,滴定至终点的现象当滴入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟不变色;
③由ClO+2I+2H+=I2+Cl+H2O、I2+2S2O32═2I+S4O62,

n=0.0012mol,C瓶溶液中NaClO的含量为![]() =4.47g/L,
=4.47g/L,


科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g)![]() CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O![]() FeO++N2;则第二步为____________________(写化学方程式)。
FeO++N2;则第二步为____________________(写化学方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_________(填“大于”“小于”或“等于”)第二步反应的活化能。
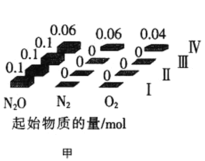
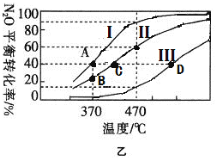
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)![]() 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
①该反应的△H_____0(填“>”或“<”)。
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为_________。B点对应的平衡常数k=________(保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是 _______________。
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应_________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3 ⑤HCl ⑥Al(OH)3
(1)pH值相同的③和⑤,分别用蒸馏水稀释至原来的![]() 倍和
倍和![]() 倍,稀释后两溶液的
倍,稀释后两溶液的![]() 值仍然相同,则
值仍然相同,则![]() ______
______![]() (填“<”或“>”或“=”)
(填“<”或“>”或“=”)
(2)室温下,![]() 值为11的①溶液中,由水电离出来的c(OH—)=______
值为11的①溶液中,由水电离出来的c(OH—)=______
(3)写出①溶液的电荷守恒:____________。
(4)写出⑥的酸式电离方程式:________________
(5)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________(用离子方程式解释)
(6)已知反应NH4++HCO3-+H2ONH3·H2O+H2CO3,该反应平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka、Kb、Kw、Kh、Ksp分别表示弱酸的电离平衡常数、弱碱的电离平衡常数,水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11
(1)有关上述常数的说法正确的是__________。
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的Ksp都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,1.0 mol·L-1 HF溶液的pH约等于__________(已知lg2≈0.3)。将浓度相等的HF与NaF溶液等体积混合,判断溶液呈_______(填“酸”、“碱”或“中”)性,并结合有关数据解释原因:_____________。
(3)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:A.NH4Cl,B.NH4SCN,C.CH3COONH4,D.NH4HCO3。回答下列问题:
①试推断NH4HCO3溶液的pH__________7(填“>”、“<”或“=”);
②将四种溶液按NH4+浓度由大到小的顺序排列是:__________(填序号)。
③NH4SCN溶液中所有离子浓度由大到小的顺序为_________。
(4)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)![]() Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1mol![]() 发生氧化还原反应时,转移的电子数目一定为2NA
发生氧化还原反应时,转移的电子数目一定为2NA
B.向含有1mol![]() 的溶液中通入足量的氯气完全反应时,转移的电子数目为2NA
的溶液中通入足量的氯气完全反应时,转移的电子数目为2NA
C.常温常压下,14g由![]() 与
与![]() 组成的混合气体含有的原子数目为NA
组成的混合气体含有的原子数目为NA
D.![]() 的浓硫酸与足量铜在加热条件下反应,生成
的浓硫酸与足量铜在加热条件下反应,生成![]() 分子的数目为0.46NA
分子的数目为0.46NA
查看答案和解析>>
科目:高中化学 来源: 题型:
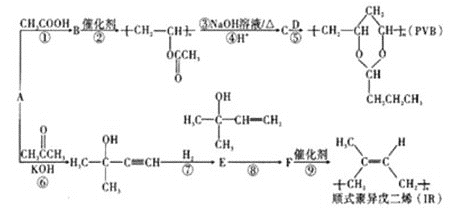
【题目】A(C2H2)是基本有机化工原料。由A制备高分子降解塑料(PVB)和IR的合成路线(部分反应条件略去)如图所示:
已知:①RCHO+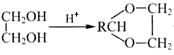 +H2O;
+H2O;
②RBr![]() RCOOH。
RCOOH。
试回答下列问题:
(1)过程①的反应类型为___,B中含氧官能团的名称是___。
(2)反应⑧的化学方程式为___。反应③的化学方程式为___。
(3)关于过程②,下列说法正确的是___(填序号)。
a.反应②属于缩聚反应
b.生成的高分子化合物还能与溴水反应而使其褪色
c.该高分子链节具有和其单体完全一样的结构
d.生成的高分子材料具有热塑性,且为混合物
e.通过质谱仪测得该高分子的平均相对分子质量为30444,可推知其n约为354
(4)F分子中最多有___个原子共平面,D的结构简式是___。
(5)G与E互为同分异构体,则G的所有同分异构体中含有碳碳双键的结构(包含E在内且不考虑顺反异构)共有___种。(已知碳碳双键与羟基直接相连不稳定,不考虑)
(6)利用题目信息,以乙烯为起始原料,选用必要的无机试剂合成丁二酸乙二酯,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,ΔH1>ΔH2的是( )
①C(s)+O2(g)=CO2(g) ΔH1;C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(g)+O2(g)==SO2(g) ΔH1;S(s)+O2(g)=SO2(g) ΔH2
③H2(g)+![]() O2(g)=H2O(l) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
O2(g)=H2O(l) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
A.①
B.②③④
C.③④
D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com