
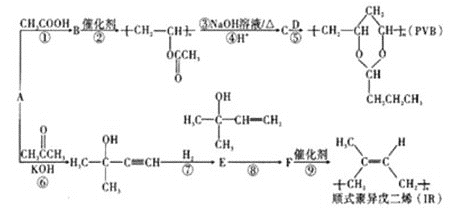
����Ŀ��A(C2H2)�ǻ����л�����ԭ�ϡ���A�Ʊ��߷��ӽ�������(PVB)��IR�ĺϳ�·��(���ַ�Ӧ������ȥ)��ͼ��ʾ��
��֪����RCHO+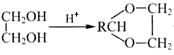 +H2O��
+H2O��
��RBr![]() RCOOH��
RCOOH��
�Իش��������⣺
��1�����̢ٵķ�Ӧ����Ϊ___��B�к��������ŵ�������___��
��2����Ӧ��Ļ�ѧ����ʽΪ___����Ӧ�۵Ļ�ѧ����ʽΪ___��
��3�����ڹ��̢ڣ�����˵����ȷ����___(�����)��
a.��Ӧ���������۷�Ӧ
b.���ɵĸ߷��ӻ����ﻹ������ˮ��Ӧ��ʹ����ɫ
c.�ø߷������ھ��к��䵥����ȫһ���Ľṹ
d.���ɵĸ߷��Ӳ��Ͼ��������ԣ���Ϊ�����
e.ͨ�������Dz�øø߷��ӵ�ƽ����Է�������Ϊ30444������֪��nԼΪ354
��4��F�����������___��ԭ�ӹ�ƽ�棬D�Ľṹ��ʽ��___��
��5��G��E��Ϊͬ���칹�壬��G������ͬ���칹���к���̼̼˫���Ľṹ(����E�����Ҳ�����˳���칹)����___�֡�(��֪̼̼˫�����ǻ�ֱ���������ȶ���������)
��6��������Ŀ��Ϣ������ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳɶ������Ҷ�����д���ϳ�·��___(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��
���𰸡��ӳɷ�Ӧ ���� 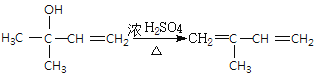 +H2O
+H2O 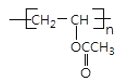 +nNaOH
+nNaOH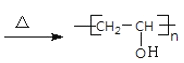 +nCH3COONa de 11 CH3CH2CH2CHO 26
+nCH3COONa de 11 CH3CH2CH2CHO 26 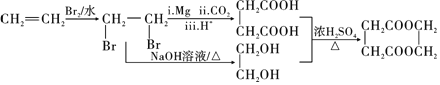
��������
�ɷ���ʽ��֪AΪCH��CH���ɸ߾���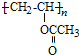 �Ľṹ����֪��Ȳ�����ᷢ���ӳɷ�Ӧ�õ�B����֪BΪCH2=CHOOCCH3����PVB�Ľṹ����֪
�Ľṹ����֪��Ȳ�����ᷢ���ӳɷ�Ӧ�õ�B����֪BΪCH2=CHOOCCH3����PVB�Ľṹ����֪![]() ����ˮ������CΪ
����ˮ������CΪ![]() ����DΪCH3CH2CH2CHO��CH��CH���ͪ��KOH�����·���̼��˫���ӳɷ�Ӧ������
����DΪCH3CH2CH2CHO��CH��CH���ͪ��KOH�����·���̼��˫���ӳɷ�Ӧ������![]() ���������������ӳɷ�Ӧ����
���������������ӳɷ�Ӧ����![]() ��F�ڴ��������µõ�˳ʽ�������ϩ
��F�ڴ��������µõ�˳ʽ�������ϩ![]()
![]()
![]() ����FΪCH2=C(CH3)CH=CH2����
����FΪCH2=C(CH3)CH=CH2����![]() ������ȥ��Ӧ����F��
������ȥ��Ӧ����F��
(1)���̢�����Ȳ�����ᷢ���ӳɷ�Ӧ����B(CH2=CHOOCCH3)��B�еĺ��������ŵ������ǣ�������
(2)��Ӧ��Ļ�ѧ����ʽΪ��![]()
![]() +H2O��
+H2O��
��Ӧ�۵Ļ�ѧ����ʽΪ��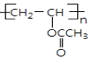 +nNaOH
+nNaOH![]()
![]() +nCH3COONa��
+nCH3COONa��
(3) a.��Ӧ�����ڼӾ۷�Ӧ��a����
b.�ø߷��Ӳ��ϲ���̼̼˫��������ˮ����Ӧ��b����
c.�ø߷�������û��̼̼˫�����䵥���к���̼̼˫�������Խṹ��ͬ��c����
d.���ɵĸ߷��Ӳ���Ϊ���ͽṹ�����������ԣ��ۺ϶Ȳ�ͬ�������ǻ���d��ȷ��
e.���ڵ���Է�������Ϊ86��ͨ�������Dz�øø߷��ӵ�ƽ����Է�������Ϊ30444������֪��n=![]() =354��e��ȷ��
=354��e��ȷ��
��ѡde��
(4)FΪCH2=C(CH3)CH=CH2������2��̼̼˫������̼̼˫��ֱ��������ԭ�Ӷ���ͬһ��ƽ���ϣ��������Ի���1��Hԭ����ͬһ��ƽ���ϣ���11���������Ϸ�����֪DΪCH3CH2CH2CHO��
(5)EΪ![]() ��G��E��Ϊͬ���칹�壬G������ͬ���칹���к���̼̼˫���Ľṹ����һ�������ſ���Ϊ�ǻ����Ѽ����纬���ǻ����ɿ���-OHȡ����ϩ��H��CH2=CH-CH2-CH2-CH3��CH3-CH=CH-CH2-CH3��CH2=C(CH3)CH2CH3��CH3C(CH3)=CHCH3��CH3CH(CH3)CH=CH2��̼̼˫�����ǻ�ֱ���������ȶ��������ǣ�-OH��ȡ����λ�ù���13�֣�
��G��E��Ϊͬ���칹�壬G������ͬ���칹���к���̼̼˫���Ľṹ����һ�������ſ���Ϊ�ǻ����Ѽ����纬���ǻ����ɿ���-OHȡ����ϩ��H��CH2=CH-CH2-CH2-CH3��CH3-CH=CH-CH2-CH3��CH2=C(CH3)CH2CH3��CH3C(CH3)=CHCH3��CH3CH(CH3)CH=CH2��̼̼˫�����ǻ�ֱ���������ȶ��������ǣ�-OH��ȡ����λ�ù���13�֣�
�纬���Ѽ�������ΪCH3-O-C4H7(8��)��CH3CH2-O-C3H5(3��)��CH3CH2CH2-O-CH=CH2��CH3C(CH3)-O-CH=CH2����13�֣����Ӧ��ͬ���칹�干26��
(6)���������Ҷ���������Ӧ�õ�Ŀ�����Ҫ���Ʊ����������Ҷ�������ϩ���巢���ӳɷ�Ӧ�õ�1��![]() �������飬1��
�������飬1��![]() �����������ˮ��õ��Ҷ����������Ϣ1��
�����������ˮ��õ��Ҷ����������Ϣ1��![]() ���������ڣ���Mg����CO2����H+�����µõ������ᣬ�ϳ�·������ͼΪ
���������ڣ���Mg����CO2����H+�����µõ������ᣬ�ϳ�·������ͼΪ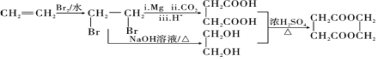 ��
��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z���ֳ����Ķ�����Ԫ�أ����γ�XY2��Z2Y��XY3��Z2Y2��Z2X�Ȼ������֪Y�����Ӻ�Z�����Ӿ�����ͬ�ĵ��Ӳ�ṹ��X���ӱ�Y���Ӷ�һ�����Ӳ㣬�Իش�
(1)X��Y��Z�ĵ��ʵľ���ֱ�����_______���壬________���壬_________���塣
(2)Z2Y2�ĵ���ʽΪ_____��Z2Y2����ˮ�Ļ�ѧ����ʽΪ_____
(3)XY3��ˮ��Һ��Z2Y2��Ӧ������һ�־���Ư���Ե�������H2Y2���仯ѧ����ʽΪ____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84����Һ����1984�걱��ijҽԺ����ʹ�ö����������ճ�������ʹ�ù㷺������Ч�ɷ���NaClO��ij��ѧ�о���ѧϰС����ʵ�����Ʊ�NaClO��Һ������������̽���ͳɷֲⶨ��
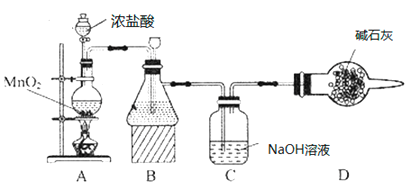
(1)��ѧϰС�鰴��ͼװ�ý���ʵ��(���ּг�װ��ʡȥ)����Ӧһ��ʱ��ֱ�ȡB��Cƿ�е���Һ����ʵ�飬ʵ���������±���
ʵ�鲽�� | ʵ������ | |
Bƿ | Cƿ | |
ʵ��1��ȡ�����μ���ɫʯ����Һ | ��죬����ɫ | ����������ɫ |
ʵ��2���ⶨ��Һ��pH | 3 | 12 |
��֪���ٱ���NaClO��ҺpHΪ11����25��Cʱ��������볣��Ϊ��H2CO3��K1=4.4��10-7��K2=4.7��10-11��HClO��K=3��10-8���ش��������⣺
��װ��Bʢװ���Լ���___________��װ��A�з�����Ӧ�����ӷ���ʽ__________��
��Cƿ��Һ�е�������NaCl��__________(�ѧʽ)��
������Cƿ��Һ����NaHCO3��Һ�������������������ʵ�飬Cƿ����Ϊ��ʵ��1����ɫʯ����Һ������ɫ��ʵ��2��Cƿ��Һ��pH=7�����ƽ���ƶ�ԭ��������ɫʯ����Һ������ɫ��ԭ��______
(2)�ⶨCƿ��Һ��NaClO����(��λ��g/L)��ʵ�鲽�����£�
��.ȡCƿ��Һ20mL����ƿ�У����������ữ���������KI��Һ���ǽ�ƿ�����ڰ�����ַ�Ӧ��
��.��0.1000mol/LNa2S2O3����Һ�ζ���ƿ�е���Һ��������Һ��ʾ�յ���ظ�����2��3�Σ�Na2S2O3��Һ��ƽ������Ϊ24.00mL��(��֪��I2+2S2O32-=2I-+S4O62-)
�ٲ���I����ƿ�з�����Ӧ�����ӷ���ʽΪ_________��
�ڵζ����յ������_____________��
��Cƿ��Һ��NaClO����Ϊ______g/L(����2λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ���ñ��͵�NaCl��Һ��ʪ��pH��ֽ������Ǧ��о���缫����ֱͨ����Դ��һ��ʱ�����a�缫����ֽ�Ӵ�������һ��˫ɫͬ��Բ����ȦΪ��ɫ����Ȧ��dz��ɫ��������˵���������( )
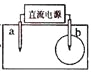
A. b�缫������B. a�缫���Դ����������
C. ��������ˮ��������D. b�缫������Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(�۵�660��)��һ��Ӧ�ù㷺�Ľ�������ҵ����![]() (�۵�2045��)�ͱ���ʯ(
(�۵�2045��)�ͱ���ʯ(![]() )������ں����Ƶá���ش��������⣺
)������ں����Ƶá���ش��������⣺
(1)�����ڻ��ý���ȴ���ڿ������ȶ����ڣ���ԭ����__________��ұ��ҵ�ϳ��ý���������ԭ��ұ�����������̵Ƚ�������д������V2O5�ڸ����·�Ӧ�Ļ�ѧ����ʽ��___________��
(2)��![]() Һ��
Һ��![]() ��Һ�����ȡ
��Һ�����ȡ![]() ����ʵ������ʢװNaF��Һ���Լ�ƿ_________(������������������)�ò���ƿ��ԭ����_______��
����ʵ������ʢװNaF��Һ���Լ�ƿ_________(������������������)�ò���ƿ��ԭ����_______��
(3)���й�����Ԫ�ص���������ȷ����__________(�����)��
A.������������ʹ�õĽ���
B.þ���Ͻ�ȿ���ȫ���ڹ��������ᣬ�ֿ���ȫ���ڹ�����NaOH��Һ
C.����������һ���������������������������������NaOH��Һ
D.��������������Ԫ��֮һ�����������������Ӧ����ʹ�����ƴ��ߺͲ;߸����������彡��
(4)ij�����ŷų��ж�����NOCl������ˮ�ͻ�����![]() ��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����NOCl�ĵ���ʽΪ_________��ˮԴ�е�
��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����NOCl�ĵ���ʽΪ_________��ˮԴ�е�![]() �����ཡ�������Σ����Ϊ�˽���ˮԴ��
�����ཡ�������Σ����Ϊ�˽���ˮԴ��![]() ��Ũ�ȣ����о���Ա�����ڼ��������������۽�
��Ũ�ȣ����о���Ա�����ڼ��������������۽�![]() ��ԭΪN2����ʱ����Ҫ��
��ԭΪN2����ʱ����Ҫ��![]() ����ʽ��������Һ�У���д���÷�Ӧ�����ӷ���ʽ��__________�����÷�Ӧת��5mol����ʱ��������
����ʽ��������Һ�У���д���÷�Ӧ�����ӷ���ʽ��__________�����÷�Ӧת��5mol����ʱ��������![]() �ڱ���µ����ԼΪ_______L��
�ڱ���µ����ԼΪ_______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����ϵ���ش����⣺

��֪������CH3Br![]() CH3��HBr��
CH3��HBr��
��C���ʱ�����һ±����ֻ�����֡�
(1)д��B���ʵ�����__________��D���ʵĽṹ��ʽ________��
(2)д����Ӧ��������________����Ӧ��������________��
(3)д����Ӧ���Ļ�ѧ����ʽ��________________________________��
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��_______________��
(5)��Ӧ�����п�������һ��C16H18���л���䱽����һ±����Ҳֻ�����֣�д�����Ľṹ��ʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O��NO��NO2�ȵ��������ǿ�����Ⱦ����е��������β���账��������ŷš�
(1) N2O�Ĵ�����N2O�����������а��������ĸ���������ִ�����ʹN2O�ֽ⡣NH3��O2�ڼ��Ⱥʹ�������������N2O�Ļ�ѧ����ʽΪ______��
(2)NO��NO2�Ĵ������ѳ�ȥN2O������β������NaOH��Һ���գ���Ҫ��ӦΪNO+NO2+2OH-=2NO2-+H2O��2NO2+2OH-=NO3-+NO2-+H2O��
�����д�ʩ�����β����NO��NO2ȥ���ʵ���______(����ĸ)��
A.�ӿ�ͨ��β��������
B.��������Һ�����ķ�ʽ����β��
C.����β�������ж��ڲ�������NaOH��Һ
�����պ����Һ��Ũ�����ᾧ�����ˣ��õ�NaNO2���壬�þ����е���Ҫ������______(�ѧʽ)�����պ��ŷŵ�β���к����ϸߵĵ���������______(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ӿ���Ŀռ�ṹʾ��ͼ��ͼ�С�ͻ�ѧʽ��M�ֱ���������ӣ�ͼ�С�ͻ�ѧʽ��N�ֱ���������ӣ���ѧʽΪMN2�ľ���ṹΪ
A.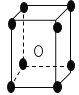 B.
B.
C.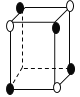 D.
D.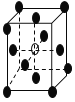
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӡ�
(1)�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ�Ͽ������·����ϳɼ״���
����һ��CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��������CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��25 �桢101 kPa�£�1gҺ̬�״���ȫȼ�շ���22.68 kJ��д���״�ȼ���ȵ��Ȼ�ѧ����ʽ��_________________��
(2)������ұ������������һ����Ӧ�ǽ�ԭ�Ͻ��ʯת����
TiO2(���ʯ)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
��֪��C(s)+O2(g)=CO2(g) ��H=��393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ��H=��566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ��H=+141 kJ/mol
��TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)����H=_______________________��
(3)���������ھ�������������ˮ������������ҵ�������ΪƯ�����������������������ҿ������������е��ʷ�Ӧ��6Ag(s)+O3(g)=3Ag2O(s) ��H=��235.8 kJ/mol��
��֪��2Ag2O(s)=4Ag(s)+O2(g) ��H= +62.2 kJ/mol����O3ת��ΪO2���Ȼ�ѧ����ʽΪ________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com