
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:_________________。
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________。
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为________________。
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol ﹣80 kJ/mol 2O3(g)=3O2(g) ΔH=﹣285 kJ/mol
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol ﹣80 kJ/mol 2O3(g)=3O2(g) ΔH=﹣285 kJ/mol
【解析】
(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据题干所给物质的量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)根据盖斯定律①×2-②+③计算;
(3)①6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
②2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,
根据盖斯定律可知①×2+②×3可得到,2O3(g)=3O2(g),以此计算反应热。
在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ ,则32g甲醇燃烧生成二氧化碳和液态水放出热量Q=32g×22.68 kJ/g=725.76kJ;因此表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol;
(2)①C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
盖斯定律计算①×2-②+③得到:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=-80 kJ/mol,则该反应的反应热ΔH=-80 kJ/mol;
(3)①6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
②2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,
根据盖斯定律可知①×2+②×3可得到,2O3(g)=3O2(g),则反应热△H=(-235.8kJ/mol)×2+(+62.2kJ/mol)×3=-285kJ/mol。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种主族元素组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A.原子半径:Y>Z>R>TB.XR2、WR2两种化合物中R的化合价相同
C.最高价氧化物对应的水化物的碱性:X>ZD.气态氢化物的稳定性:W<R<T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。回答下列问题:
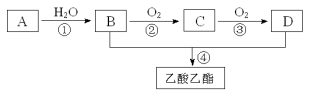
(1)A转化为B的反应类型___________。
(2)D分子中官能团的名称_______。
(3)写出B与金属钠反应的化学方程式是____________________。
(4)下列说法正确的是________________。
A.B分子中的所有原子在同一平面上
B.一定条件下,C中的官能团可以用银氨溶液来检验
C.A可以在其他条件下被氧气氧化成乙酸
D.A使酸性KMnO4溶液褪色和使溴水褪色,其原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是
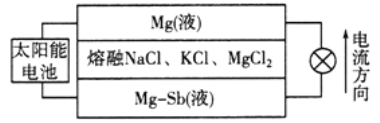
A. 放电时,Mg(液)层的质量减小
B. 放电时,正极反应为:Mg2++2e===Mg
C. 该电池充电时,Mg—Sb(液)层的质量增大
D. 该电池充电时,C1向下层方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下,再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为
A.88%B.75%C.25%D.32%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹在细胞水平上能有效抑制新型冠状病毒2019-nCoV的感染。其中种以芳香化合物A 和乙酰乙酸乙酯(![]() )为原料合成磷酸氯喹的合成路线如图:
)为原料合成磷酸氯喹的合成路线如图:
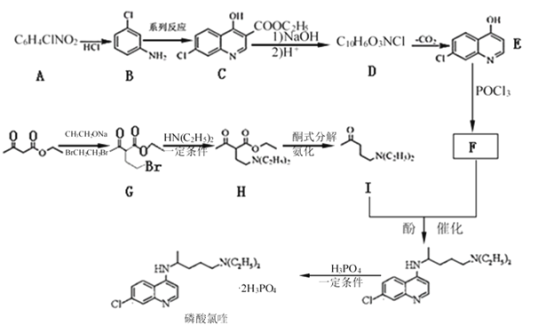
已知:①![]() 具有酸性
具有酸性
②![]()
![]()
![]()
③R1NH2+R2X![]() R1NHR2+HX(X表示卤原子)。
R1NHR2+HX(X表示卤原子)。
请回答下列问题:
(1) E中含氧官能团的名称是________,G→H的反应类型是________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B与足量的氢气加成后的产物M的结构简式,用星号(*)标出M中的手性碳_________。
(3) F的结构简式是_______。
(4)写出C与NaOH反应的化学方程式为___________。
(5) N是H的同分异构体,符合下列条件的N的同分异构体共有____种: 写出其中一种核磁共振氢谱显示环上只有3组峰,且峰面积之比为4:4:1的结构简式________。
①含有基团![]() 、-N(C2H5)2
、-N(C2H5)2
②酸性水解产物中含有乙酸
③能与金属钠反应生成H2
(6)参照上述信息和合成路线,请设计以苯和1,4 -丁二醇为原料合成![]() 的合成路线(无机试剂任选)____________。
的合成路线(无机试剂任选)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是
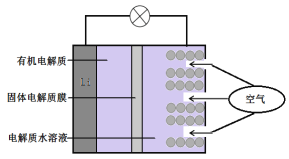
A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com