
【题目】磷酸氯喹在细胞水平上能有效抑制新型冠状病毒2019-nCoV的感染。其中种以芳香化合物A 和乙酰乙酸乙酯(![]() )为原料合成磷酸氯喹的合成路线如图:
)为原料合成磷酸氯喹的合成路线如图:
已知:①![]() 具有酸性
具有酸性
②![]()
![]()
![]()
③R1NH2+R2X![]() R1NHR2+HX(X表示卤原子)。
R1NHR2+HX(X表示卤原子)。
请回答下列问题:
(1) E中含氧官能团的名称是________,G→H的反应类型是________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B与足量的氢气加成后的产物M的结构简式,用星号(*)标出M中的手性碳_________。
(3) F的结构简式是_______。
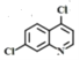
(4)写出C与NaOH反应的化学方程式为___________。
(5) N是H的同分异构体,符合下列条件的N的同分异构体共有____种: 写出其中一种核磁共振氢谱显示环上只有3组峰,且峰面积之比为4:4:1的结构简式________。
①含有基团![]() 、-N(C2H5)2
、-N(C2H5)2
②酸性水解产物中含有乙酸
③能与金属钠反应生成H2
(6)参照上述信息和合成路线,请设计以苯和1,4 -丁二醇为原料合成![]() 的合成路线(无机试剂任选)____________。
的合成路线(无机试剂任选)____________。
【答案】羟基 取代 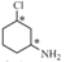
 19
19 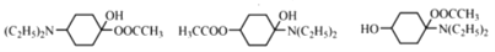 (任写一种)
(任写一种) 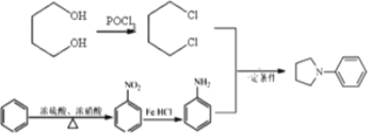
【解析】
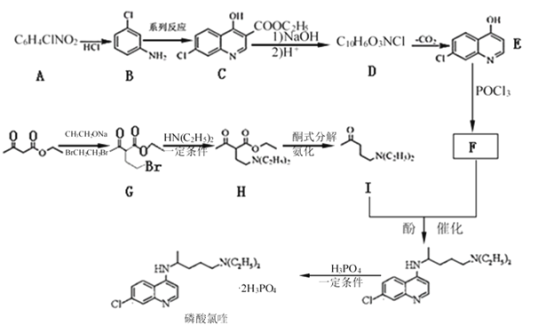
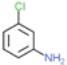
根据已知信息②,在Fe/HCl的条件下-NO2发生还原转化为-NH2,B为间氨基氯苯,则A为间硝基氯苯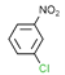 ;C中含有酚羟基与氢氧化钠发生酸碱中和,含有酯基发生碱性条件的水解,苯环上的氯原子性质稳定需要一定压强下可以水解,常温不与氢氧化钠反应,酸化后可以得到D
;C中含有酚羟基与氢氧化钠发生酸碱中和,含有酯基发生碱性条件的水解,苯环上的氯原子性质稳定需要一定压强下可以水解,常温不与氢氧化钠反应,酸化后可以得到D ,D经脱羧反应(-CO2)生成E,I和F发生信息③的反应,可知E结构中羟基被取代为氯原子,则F为
,D经脱羧反应(-CO2)生成E,I和F发生信息③的反应,可知E结构中羟基被取代为氯原子,则F为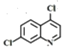 ;乙酰乙酸乙酯在乙醇钠的作用下与1,2-二溴乙烷发生取代反应,生成HBr和G,G与HN(C2H5)2在一定条件下取代反应(参考信息③),生成HBr和H,以此作答。
;乙酰乙酸乙酯在乙醇钠的作用下与1,2-二溴乙烷发生取代反应,生成HBr和G,G与HN(C2H5)2在一定条件下取代反应(参考信息③),生成HBr和H,以此作答。
(1) E中含氧官能团的名称是羟基;参考已知信息③,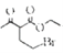 与HN(C2H5)2在一定条件下生成和
与HN(C2H5)2在一定条件下生成和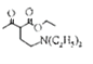 和HBr,故G→H的反应类型是取代反应;
和HBr,故G→H的反应类型是取代反应;
(2) 与足量的氢气加成后的产物M为
与足量的氢气加成后的产物M为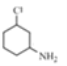 ,连接Cl原子的碳、连接N原子的碳均连接了四个不同基团,故为手性碳原子,可表示为
,连接Cl原子的碳、连接N原子的碳均连接了四个不同基团,故为手性碳原子,可表示为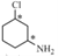 ;
;
(3)根据分析,F的结构简式是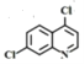 ;
;
(4)根据分析,C中含有酚羟基与NaOH发生酸碱中和,含有酯基在碱性条件下发生水解生成羧酸盐和乙醇,苯环上的氯原子稳定,需要在一定压强下才能反应,故C与NaOH反应的化学方程式为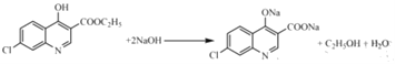 ;
;
(5)H的同分异构体N能水解且酸性水解产物含有乙酸,说明分子内含有CH3COO-,能与金属钠反应生成氢气,说明含有-OH,另已知分子含有含有![]() 和-N(C2H5)2;若CH3COO-、-OH、-N(C2H5)2连接
和-N(C2H5)2;若CH3COO-、-OH、-N(C2H5)2连接![]() 的不同碳原子上,同分异构体有10种(类似于苯环上ABC的10种结构);若两两基团连接相同碳原子(三种基团两两组合有三种情况),另外一个基团可以邻间对放置,则可得到9种同分异构体;根据上述分析符合条件的N的同分异构体共19种; 其中核磁共振氢谱显示环上只有3组峰,且峰面积之比为4:4:1,根据要求应该在两两组合中对位结构,故结构简式为
的不同碳原子上,同分异构体有10种(类似于苯环上ABC的10种结构);若两两基团连接相同碳原子(三种基团两两组合有三种情况),另外一个基团可以邻间对放置,则可得到9种同分异构体;根据上述分析符合条件的N的同分异构体共19种; 其中核磁共振氢谱显示环上只有3组峰,且峰面积之比为4:4:1,根据要求应该在两两组合中对位结构,故结构简式为![]() (任写一种);
(任写一种);
(6)根据产物结构分析,出现R1NR2R3需要运用信息③R1NH2+R2X![]() R1NHR2+HX,可知R1代表苯环,R2R3代表环状结构,需要在苯环上发生硝化反应,再被还原得苯胺,R2R3需要出现卤素原子,根据信息采用POCl3引入两个氯原子,然后发生类似于信息③反应进行合成,则路线为
R1NHR2+HX,可知R1代表苯环,R2R3代表环状结构,需要在苯环上发生硝化反应,再被还原得苯胺,R2R3需要出现卤素原子,根据信息采用POCl3引入两个氯原子,然后发生类似于信息③反应进行合成,则路线为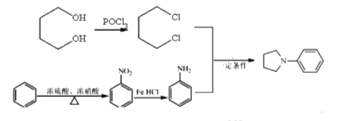 。
。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用11.92gNaClO配成溶液,向其中加入0.01molNa2SX恰好完全反应,生成Na2SO4和NaCl。则Na2SX 中的 x=__________(写出简要计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯巴比妥是镇静、安眠类药物,其合成路线如下:
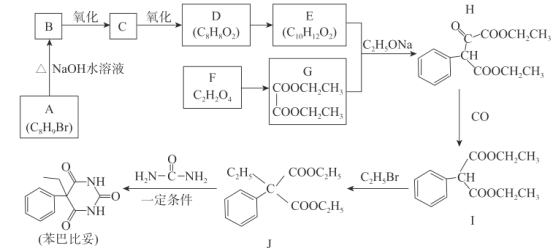
请回答下列问题:
(1)G的化学名称为_________,C的分子式为__________。
(2)F+X→G+ H2O,X的结构简式为____________。
(3)H中含有的官能团名称为__________,I→J的反应类型为______________。
(4)同时满足下列条件的E的同分异构体共有______种。
①含有苯环且苯环上有两个取代基
②能发生水解反应且能发生银镜反应
(5)化合物J→苯巴比妥的化学方程式为________________________________。
(6)以1,3-丁二烯、乙醇和尿素(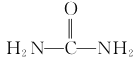 )为原料合成
)为原料合成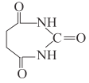 所需无机试剂任选,请写出流程:_____________________________
所需无机试剂任选,请写出流程:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:_________________。
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________。
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
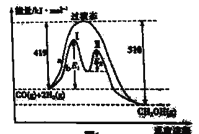
A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_______(填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=_____kPa/min;该温度下反应的平衡常数Kp=______。(分压=总压×物质的量分数)。
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____ K(L); 压强:p(M)__2p(L)。(填“>”“<”或“=”)

(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯(![]() )。电解时,阴极的电极反应式是_________。
)。电解时,阴极的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
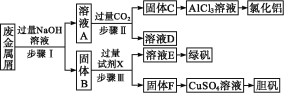
完成下列填空:
(1)写出步骤Ⅰ反应的离子方程式:___。
(2)试剂X是___,溶液D是___。
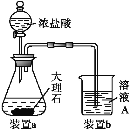
(3)在步骤Ⅱ中,用如图装置制取CO2并通入溶液A中。一段时间后,仍观察不到烧杯中产生白色沉淀。为了固体C的生成,在药品和装置上可采取的改进措施是___。
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:___。
(5)将固体F继续加入热的稀硫酸,同时不断鼓入空气,固体溶解得CuSO4溶液,写出反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.石墨晶体呈层状结构,每个碳原子只有3个价电子形成共价键
B.白磷是正四面体分子,键角是109°28’,1摩尔白磷含共价键6NA个
C.臭氧是直线型分子,等质量的臭氧和氧气所含的氧原子数相同
D.S8是分子晶体,8个硫原子形成环状结构,摩尔质量为256g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子,已知各离子的浓度均相等,进行如下实验:
中的几种离子,已知各离子的浓度均相等,进行如下实验:
![]() 取少量该溶液,加入足量稀硫酸,无明显现象。
取少量该溶液,加入足量稀硫酸,无明显现象。
![]() 取
取![]() 反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生。下列说法不正确的是
反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生。下列说法不正确的是![]()
![]()
A.该溶液中肯定不存在![]() 、
、![]() 、
、![]()
B.另取该溶液,加入适量氯水和淀粉溶液,若溶液显蓝色,即可确定该溶液中一定不含![]()
C.取原溶液进行焰色反应,显黄色,则溶液中一定含有的离子有六种
D.该溶液中肯定存在![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com