
【题目】CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下,再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为
A.88%B.75%C.25%D.32%
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】新型材料 AIN 应用前景广泛,对其制备过程的研究成为热点。
(1)将物质的量均为a mol 的 Al2O3与N2 充入恒温恒容密闭容器中,控制温度发生反应:2Al2O3(s)+2N2(g) ![]() 4AlN(s) +3O2(g) △H>0。
4AlN(s) +3O2(g) △H>0。
①下列可作为反应达到平衡的判据是_________(填序号)。
A.固体的质量不再改变
B.2v正(N2)=3v逆(O 2)
C.△H 不变
D.容器内气体的压强不变
E.N2分子数与 O2 分子数比为 2:3
②在起始压强为p的反应体系中,平衡时 N2的转化率为α,则上述反应的平衡常数 Kp__________(对于气相反应,用某组分 B 的平衡压强 p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B) =p总·x(B) ,p总为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③为促进反应的进行,实际生产中需加入焦炭,其原因是____________。
(2)铝粉与 N2 在一定温度下可直接生成 AlN, 加入少量 NH4Cl 固体可促进反应。将等质量的A1粉与不同量的 NH4Cl混合均匀后置于充 N2的密闭容器中,电火花引燃,产品中 AlN的质量分数[ω(AlN)] 随原料中ω(NH4Cl)的变化如图1所示,燃烧过程中温度随时间变化如图2所示。则:
①固体混合物中,ω(NH4Cl)的最佳选择是__________。
②结合图2解释当ω(NH4Cl)超过一定值后,ω(AlN)明显减少的原因__________。

(3)AIN粉末会缓慢发生水解反应,粒径为100 nm 的 AlN 粉末水解时溶液 pH的变化如图3 所示。

①AlN 粉末水解的化学方程式是______________。
②相同条件下,请在图3中画出粒径为40 nm 的AlN粉末水解的变化曲线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①由非金属元素组成的化合物一定是共价化合物 ②离子化合物一定含离子键,可能含极性键或非极性键 ③非极性键既可能存在于单质和共价化合物中,也可能存在于离子化合物中 ④所有化合物都含有化学键 ⑤元素形成化合物时,不一定都达到稀有气体元素原子的电子层结构 ⑥任何元素的原子都是由核外电子和核内中子、质子组成的⑦化学反应一定伴随着能量的变化 ⑧质子数相同的微粒一定属于同种元素
A.②③④⑤⑦B.②③⑤⑦⑧C.①③④⑥⑦D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数之和为17,其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
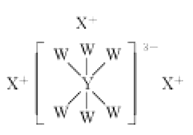
A.X、Y、Z的最高价氧化物对应水化物两两之间均能反应
B.X与Z形成的化合物会抑制水的电离
C.W的简单气态氢化物的热稳定性比Z的弱
D.原子半径: Z>Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:_________________。
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________。
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HC1物质的量关系如图所示(忽略气体的溶解和HC1的挥发).下列说法不正确的是
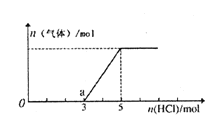
A. 0点溶液中所含溶质的化学式为NaOH、Na2CO3
B. 0到a点发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3-
C. 通入CO2气体的体积在标准状况下为22.4L
D. NaOH溶液的物质的量浓度为2.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
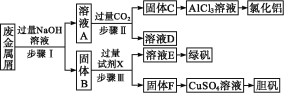
完成下列填空:
(1)写出步骤Ⅰ反应的离子方程式:___。
(2)试剂X是___,溶液D是___。
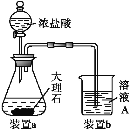
(3)在步骤Ⅱ中,用如图装置制取CO2并通入溶液A中。一段时间后,仍观察不到烧杯中产生白色沉淀。为了固体C的生成,在药品和装置上可采取的改进措施是___。
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:___。
(5)将固体F继续加入热的稀硫酸,同时不断鼓入空气,固体溶解得CuSO4溶液,写出反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图,关于乙醇在各种反应中断裂键的说法不正确的是( )
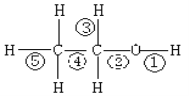
A. 乙醇和钠反应,键①断裂
B. 在铜催化下和O2反应,键①③断裂
C. 1700C乙醇制乙烯时,键②⑤断裂
D. 1400C乙醇制乙醚的反应,键①⑤断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料。以下是丙烯合成F的路线(反应条件及无机产物忽略)。、
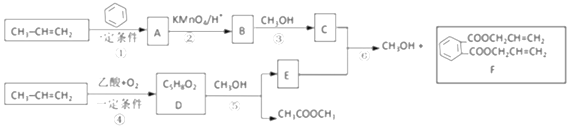
已知:①![]() +2CH2=CH2
+2CH2=CH2![]()
![]() 或
或![]()
②一定条件下,脂与醇会发生交换反应:RCOOR′+R"OH![]() RCOOR"+R′OH
RCOOR"+R′OH
③![]()
![]()
![]()
(1)反应①的反应类型是________反应;由反应①生成的A有______种可能的结构,这些不同结构的A在酸性高锰酸钾作用下都得到B。反应①还会生成A的一种同分异构体M。M中有3种化学环境不同的氢,则M的结构简式为_________。
(2)写出D的结构简式______,E中官能团的名称_____。
(3)写出反应⑥的化学方程式____________。
(4)写出以丙烯为原料制备甘油的流程图__________(其他原料任选,可选用提目中提供的信息)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com