
【题目】丙烯是重要的有机化工原料。以下是丙烯合成F的路线(反应条件及无机产物忽略)。、
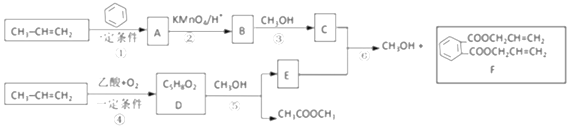
已知:①![]() +2CH2=CH2
+2CH2=CH2![]()
![]() 或
或![]()
②一定条件下,脂与醇会发生交换反应:RCOOR′+R"OH![]() RCOOR"+R′OH
RCOOR"+R′OH
③![]()
![]()
![]()
(1)反应①的反应类型是________反应;由反应①生成的A有______种可能的结构,这些不同结构的A在酸性高锰酸钾作用下都得到B。反应①还会生成A的一种同分异构体M。M中有3种化学环境不同的氢,则M的结构简式为_________。
(2)写出D的结构简式______,E中官能团的名称_____。
(3)写出反应⑥的化学方程式____________。
(4)写出以丙烯为原料制备甘油的流程图__________(其他原料任选,可选用提目中提供的信息)。
【答案】加成反应 3 ![]() CH3COOCH2CH=CH2 碳碳双键、羟基
CH3COOCH2CH=CH2 碳碳双键、羟基 ![]() +2CH2=CH—CH2OH
+2CH2=CH—CH2OH ![]() 2CH3OH+
2CH3OH+![]() CH3—CH=CH2
CH3—CH=CH2![]() CH3COOCH2CH=CH2
CH3COOCH2CH=CH2![]() CH3COOCH2CHBr—CH2Br
CH3COOCH2CHBr—CH2Br![]() HOCH2CH(OH)CH2OH
HOCH2CH(OH)CH2OH
【解析】
根据合成路线分析可知,C、E发生已知反应②得到CH3OH和F(![]() ),CH3—CH=CH2与
),CH3—CH=CH2与![]() 发生已知反应①的到A,A再发生已知反应③得到B,B与CH3OH发生酯化反应得到C,则C为
发生已知反应①的到A,A再发生已知反应③得到B,B与CH3OH发生酯化反应得到C,则C为![]() ,E为CH2=CH—CH2OH,B为
,E为CH2=CH—CH2OH,B为![]() ,A可能为
,A可能为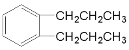 、
、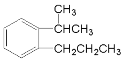 或
或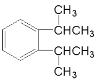 ,又D与CH3OH发生已知反应②得到E和CH3COOCH3,D的分子式为C5H8O2,则D为CH3COOCH2CH=CH2,据此可分析解答问题。
,又D与CH3OH发生已知反应②得到E和CH3COOCH3,D的分子式为C5H8O2,则D为CH3COOCH2CH=CH2,据此可分析解答问题。
(1)由上述分析可知,已知反应①为碳碳双键的加成反应,CH3—CH=CH2与![]() 发生已知反应①的到A,A可能为
发生已知反应①的到A,A可能为 、
、 或
或 三种结构,反应①还会生成A的一种同分异构体M,M中有3种化学环境不同的氢,则M的结构式是
三种结构,反应①还会生成A的一种同分异构体M,M中有3种化学环境不同的氢,则M的结构式是![]() ,故答案为:加成反应;3;
,故答案为:加成反应;3;![]() ;
;
(2)根据上述分析可知,D与CH3OH发生已知反应②得到E和CH3COOCH3,D的分子式为C5H8O2,则D为CH3COOCH2CH=CH2,E为CH2=CH—CH2OH,含有的官能团有碳碳双键和羟基,故答案为:CH3COOCH2CH=CH2;碳碳双键、羟基;
(3)反应⑥为C(![]() )和E(CH2=CH—CH2OH)发生已知反应②得到CH3OH和F(
)和E(CH2=CH—CH2OH)发生已知反应②得到CH3OH和F(![]() ),反应方程式为
),反应方程式为![]() +2CH2=CH—CH2OH
+2CH2=CH—CH2OH ![]() 2CH3OH+
2CH3OH+![]() ,故答案为:
,故答案为:![]() +2CH2=CH—CH2OH
+2CH2=CH—CH2OH ![]() 2CH3OH+
2CH3OH+![]() ;
;
(4)结合上述转化关系,可得到以丙烯为原料制备甘油的合成路线:CH3-CH=CH2![]() CH3COOCH2CH=CH2
CH3COOCH2CH=CH2![]() CH3COOCH2CHBr—CH2Br
CH3COOCH2CHBr—CH2Br![]() HOCH2CH(OH)CH2OH,故答案为:CH3-CH=CH2
HOCH2CH(OH)CH2OH,故答案为:CH3-CH=CH2![]() CH3COOCH2CH=CH2
CH3COOCH2CH=CH2![]() CH3COOCH2CHBr—CH2Br
CH3COOCH2CHBr—CH2Br![]() HOCH2CH(OH)CH2OH。
HOCH2CH(OH)CH2OH。


科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下,再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为
A.88%B.75%C.25%D.32%
查看答案和解析>>
科目:高中化学 来源: 题型:
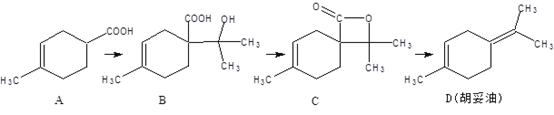
【题目】胡妥油(D)用作香料的原料,它可由A合成得到:
下列说法正确的是
A. 若有机物A是由异戊二烯)和丙烯酸加热得到的,则该反应的反应类型属于加成反应
B. 有机物B既能与O2催化氧化生成醛,又能跟NaHCO3溶液反应放出CO2气体
C. 有机物C的所有同分异构体中不可能有芳香族化合物存在
D. 有机物D分子中所有碳原子一定共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
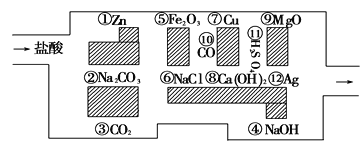
(1)迷宫内12种物质中属于碱性氧化物的有________________,写出其中一种与盐酸反应的化学方程式________________________________________。
(2)迷宫内12种物质中金属单质及其活动顺序是_________________,试写一个相互置换的化学方程式:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是
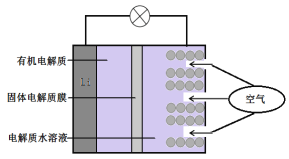
A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃分子中若含有双键、叁键或环,其碳原子所结合的氢原子则少于同碳原子数对应烷烃所含的氢原子数,亦具有一定的不饱和度![]() 用
用![]() 表示
表示![]() 。下表列出几种烃的不饱和度:
。下表列出几种烃的不饱和度:
有机物 | 乙烯 | 乙炔 | 环己烷 | 苯 |
| 1 | 2 | 1 | 4 |
据此下列说法不正确的是![]()
![]()
A.![]() 的不饱和链烃再结合6molH即达到饱和
的不饱和链烃再结合6molH即达到饱和
B.![]() 的
的![]() 等于6
等于6
C.![]() 与环丁烷的不饱和度相同
与环丁烷的不饱和度相同
D.![]() 的不饱和度与
的不饱和度与![]() 、
、![]() 的不饱和度相同
的不饱和度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C2H6(g)![]() C2H4(g)+H2(g) H1 >0。
C2H4(g)+H2(g) H1 >0。
②C2H6(g)+![]() =2CO2(g)+3H2O(l) H 2 =-1559.8 kJ·mol-1
=2CO2(g)+3H2O(l) H 2 =-1559.8 kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) H 3=-1411.0 kJ·mol-1
下列叙述正确的是
A.升温或加压均能提高①中乙烷的转化率
B.①中断键吸收的能量少于成键放出的能量
C.用H 2和H 3可计算出①中的H
D.推测1 mol C2H2(g)完全燃烧放出的热量小于1411.0 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究来源于真菌的天然产物L的合成对抗肿瘤药物研发有着重要意义,其合成路线主要分为两个阶段:
I.合成中间体F

已知:ⅰ.TBSCl为![]()
ⅱ. 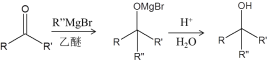
(1)A中含氧官能团名称__________。
(2)B的结构简式是__________。
(3)试剂a是__________。
(4)TBSCl的作用是__________。
II. 合成有机物L

已知: ![]()
(5)H中含有两个酯基,H的结构简式是__________。
(6)I→J的反应方程式是__________。
(7)K→L的转化中,两步反应的反应类型依次是__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁氧化合物循环分解水制H2
已知:H2O(l)===H2(g)+![]() O2(g) ΔH1=+285.5 kJ/mol
O2(g) ΔH1=+285.5 kJ/mol
6FeO(s)+O2(g) ===2Fe3O4(s) ΔH2=-313.2 kJ/mol
则:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH3=___________
(2)Fe2O3与CH4反应可制备“纳米级”金属铁,其反应为: 3CH4(g) + Fe2O3(s) ![]() 2Fe(s) +6H2(g) +3CO(g) ΔH4
2Fe(s) +6H2(g) +3CO(g) ΔH4
①此反应的化学平衡常数表达式为_________________________________。
②在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”金属铁,然后分别充入amolCO和2a molH2,三个容器的反应温度分别保持T1、T2、T3,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是___________(选填“Ⅰ”“Ⅱ”或“Ⅲ”);制备“纳米级”金属铁的反应:ΔH4 _____ 0(填“>”或“<”)。
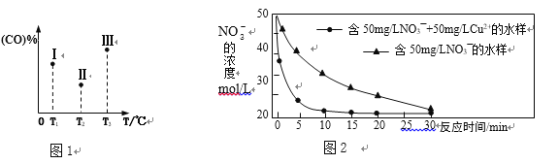
③在T℃下,向某恒容密闭容器中加入3molCH4(g)和2mol Fe2O3(s)进行上述反应,反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。10 min内用Fe2O3(s)表示的平均反应速率为_______g·min-1; T℃下该反应的Kp = _____________________;T℃下若起始时向该容器中加入2molCH4(g)、4mol Fe2O3(s)、1molFe(s)、2mol H2(g)、2molCO(g),则起始时v (正)______v (逆) (填“>”、“<”或“=”)。
(3)纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O
①研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是_________________。
②相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异,图2中所产生的差异的可能原因是__________________________________________________(答一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com