
【题目】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
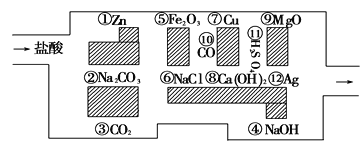
(1)迷宫内12种物质中属于碱性氧化物的有________________,写出其中一种与盐酸反应的化学方程式________________________________________。
(2)迷宫内12种物质中金属单质及其活动顺序是_________________,试写一个相互置换的化学方程式:________________________________________
【答案】⑤⑨ Fe2O3 +6HCl =2FeCl3+3H2O (或MgO) ①⑦ Zn+2HCl = ZnCl2+H2↑
【解析】
盐酸是强酸,能跟金属活动顺序表中氢位前的金属反应如Zn、Fe等,不能跟氢位后的金属如Cu、Ag等反应,盐酸能与弱酸的盐反应如Na2CO3等;盐酸能与碱性氧化物反应如Fe2O3、 MgO等;盐酸能与碱发生中和反应如NaOH、Ca(OH)2等,由此分析。
(1)能与酸反应生成盐和水的氧化物称为碱性氧化物,
Fe2O3+6HCl=2FeCl3+3H2O、MgO+2HC1=MgCl2+H2O 所以Fe2O3和MgO属于碱性氧化物,即⑤⑨属于碱性氧化物;它们与盐酸反应的离子方程式为Fe2O3+6HCl=2FeCl3+3H2O、MgO+2HC1=MgCl2+H2O;
(2)根据金属活动顺序表,越靠前的金属越活波,因此活动性由强到弱的顺序是Zn>Cu>Ag;即活动性由强到弱的顺序是①⑦;它们之间发生置换反应的化学方程式有:Zn+2HCl = ZnCl2+H2↑等。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数之和为17,其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
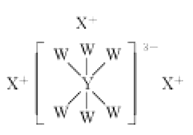
A.X、Y、Z的最高价氧化物对应水化物两两之间均能反应
B.X与Z形成的化合物会抑制水的电离
C.W的简单气态氢化物的热稳定性比Z的弱
D.原子半径: Z>Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图,关于乙醇在各种反应中断裂键的说法不正确的是( )
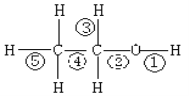
A. 乙醇和钠反应,键①断裂
B. 在铜催化下和O2反应,键①③断裂
C. 1700C乙醇制乙烯时,键②⑤断裂
D. 1400C乙醇制乙醚的反应,键①⑤断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
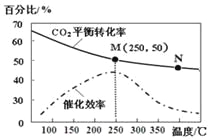
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料。以下是丙烯合成F的路线(反应条件及无机产物忽略)。、
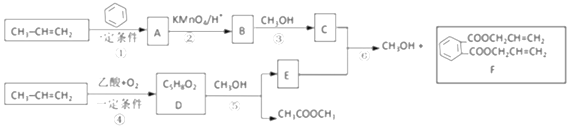
已知:①![]() +2CH2=CH2
+2CH2=CH2![]()
![]() 或
或![]()
②一定条件下,脂与醇会发生交换反应:RCOOR′+R"OH![]() RCOOR"+R′OH
RCOOR"+R′OH
③![]()
![]()
![]()
(1)反应①的反应类型是________反应;由反应①生成的A有______种可能的结构,这些不同结构的A在酸性高锰酸钾作用下都得到B。反应①还会生成A的一种同分异构体M。M中有3种化学环境不同的氢,则M的结构简式为_________。
(2)写出D的结构简式______,E中官能团的名称_____。
(3)写出反应⑥的化学方程式____________。
(4)写出以丙烯为原料制备甘油的流程图__________(其他原料任选,可选用提目中提供的信息)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是中学化学中常用于混合物分离和提纯的装置:
A 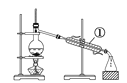 B
B 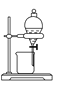 C
C 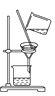 D
D 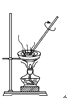
请根据装置图回答下列问题:
(1)从氯化钾溶液中得到氯化钾固体选择装置______(填代表装置图的字母,下同);除去自来水中的Cl-等杂质得到蒸馏水,选择装置_____。
(2)从碘水中分离出I2,选择装置____,该分离方法的名称为________。
(3)装置A中①的名称是________,冷凝水流动的方向是__________。
(4)分液时要注意及时________,防止上层液体流下。分液后漏斗内剩余的液体从分液漏斗的________(填“上口”或“下口”)倒入烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯度硅。以下是实验室制备SiCl4的装置示意图。

请回答下列问题:
(1)仪器D的名称_____________。
(2)装置A的硬质玻璃管中发生反应的化学方程式是________________。
(3)C中吸收尾气一段时间后,吸收液中存在多种阴离子,下列有关吸收液中离子检验的说法正确的是_____。
A.取少量吸收液加入AgNO3溶液,若生成白色沉淀,则说明一定存在Cl-
B.取少量吸收液,滴加溴水,若溴水褪色,则说明一定存在SO32-
C.取少量吸收液,加过量BaCl2溶液,过滤出沉淀,向沉淀中加过量稀盐酸,若沉淀部分溶解,且有气泡产生,则说明一定存在SO32-
D.取少量吸收液,加硫酸酸化后再加淀粉碘化钾溶液,若溶液变蓝,则说明一定存在ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com