
【题目】新型材料 AIN 应用前景广泛,对其制备过程的研究成为热点。
(1)将物质的量均为a mol 的 Al2O3与N2 充入恒温恒容密闭容器中,控制温度发生反应:2Al2O3(s)+2N2(g) ![]() 4AlN(s) +3O2(g) △H>0。
4AlN(s) +3O2(g) △H>0。
①下列可作为反应达到平衡的判据是_________(填序号)。
A.固体的质量不再改变
B.2v正(N2)=3v逆(O 2)
C.△H 不变
D.容器内气体的压强不变
E.N2分子数与 O2 分子数比为 2:3
②在起始压强为p的反应体系中,平衡时 N2的转化率为α,则上述反应的平衡常数 Kp__________(对于气相反应,用某组分 B 的平衡压强 p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B) =p总·x(B) ,p总为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③为促进反应的进行,实际生产中需加入焦炭,其原因是____________。
(2)铝粉与 N2 在一定温度下可直接生成 AlN, 加入少量 NH4Cl 固体可促进反应。将等质量的A1粉与不同量的 NH4Cl混合均匀后置于充 N2的密闭容器中,电火花引燃,产品中 AlN的质量分数[ω(AlN)] 随原料中ω(NH4Cl)的变化如图1所示,燃烧过程中温度随时间变化如图2所示。则:
①固体混合物中,ω(NH4Cl)的最佳选择是__________。
②结合图2解释当ω(NH4Cl)超过一定值后,ω(AlN)明显减少的原因__________。

(3)AIN粉末会缓慢发生水解反应,粒径为100 nm 的 AlN 粉末水解时溶液 pH的变化如图3 所示。

①AlN 粉末水解的化学方程式是______________。
②相同条件下,请在图3中画出粒径为40 nm 的AlN粉末水解的变化曲线____________。
【答案】AD ![]() p 消耗O2、提供能量,均能使平衡向右移动 3 % NH4Cl分解吸热造成温度降低,不利于Al 与N2反应 AlN + 4H2O
p 消耗O2、提供能量,均能使平衡向右移动 3 % NH4Cl分解吸热造成温度降低,不利于Al 与N2反应 AlN + 4H2O ![]() Al(OH)3 + NH3H2O
Al(OH)3 + NH3H2O 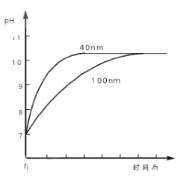
【解析】
(1) ①根据反应达到平衡后,正逆反应速率,各成分的浓度不变及由此衍生的其它物理量进行分析;
②平衡时N2的转化率为α,由于反应物中只有N2是气体,所以起始压强p即为起始时N2的分压,列三段式求Kp;
③碳在氧气中燃烧放出热量,焦炭既可以消耗氧气,使生成物浓度降低,又可以提供热量,这两方面的作用都可以使平衡右移;
(2)①根据图像分析,当ω(NH4Cl)=3%时,ω(AlN)最大;
②从图2可以看出,反应过程中温度会降低。ω(NH4Cl)=3%时的温度比ω(NH4Cl)=1%时的温度降低得更多。这是因为NH4Cl分解吸热,当ω(NH4Cl)超过一定值后,NH4Cl分解吸热造成温度降低不利于Al 与N2反应,导致ω(AlN)明显减少;
(3)①AIN粉末会缓慢发生水解反应,生成Al(OH)3和NH3;
②相同条件下,由于粒径为40nm的AlN粉末和水的接触面积更大,所以其水解速率大于粒径为100nm的AlN粉末的水解速率,由于固体不影响平衡,所以最终溶液的pH是相同。
(1)①A.消耗2mol Al2O3会生成4molAlN,固体质量减少,当固体的质量不再改变时,反应达到了平衡状态;
B.当3v正(N2)=2v逆(O2)时,正逆反应速率相等,反应达到了平衡状态,但2v正(N2)=3v逆(O2)表示的正逆反应速率不相等,不是平衡状态;
C.△H取决于反应物和生成物的总能量的相对大小,和是否平衡无关;
D.在恒温恒容条件下,容器内的压强和气体的物质的量成正比。该反应是反应前后气体分子数不相等的反应,在平衡建立过程中,气体总物质的量一直在改变,只有达到平衡时,气体总物质的量才不再不变,即容器内压强才不变,所以当容器内气体的压强不变时,反应达到了平衡状态;
E.N2分子数与 O2 分子数之比和起始投料以及转化率有关,当N2分子数与O2分子数比为 2:3时,反应不一定是平衡状态;
故选AD。
②反应2Al2O3(s)+2N2(g) ![]() 4AlN(s) +3O2(g),在起始时加入的是等物质的量的Al2O3与N2,由于反应物中只有N2是气体,所以起始压强p即为起始时N2的分压,列三段式求Kp,已知平衡时N2的转化率为α,则
4AlN(s) +3O2(g),在起始时加入的是等物质的量的Al2O3与N2,由于反应物中只有N2是气体,所以起始压强p即为起始时N2的分压,列三段式求Kp,已知平衡时N2的转化率为α,则
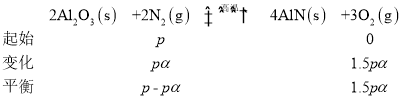
Kp=![]() =
=![]() p。
p。
③为促进反应的进行,实际生产中需加入焦炭,焦炭和氧气反应,放出热量。焦炭既可以消耗氧气,使生成物浓度降低,又可以提供热量,这两方面的作用都可以使平衡右移,从而促进反应的进行。
(2)①从图1可以看出,当ω(NH4Cl)=3%时,ω(AlN)最大,所以最佳选择是ω(NH4Cl)=3%。
②从图2可以看出,反应过程中温度会降低。ω(NH4Cl)=3%时的温度比ω(NH4Cl)=1%时的温度降低得更多。这是因为NH4Cl分解吸热,当ω(NH4Cl)超过一定值后,NH4Cl分解吸热造成温度降低不利于Al 与N2反应,导致ω(AlN)明显减少
(3)①AIN粉末会缓慢发生水解反应,生成Al(OH)3和NH3,AlN 粉末水解的化学方程式是AlN + 4H2O ![]() Al(OH)3 + NH3H2O。
Al(OH)3 + NH3H2O。
②相同条件下,由于粒径为40nm的AlN粉末和水的接触面积更大,所以其水解速率大于粒径为100nm的AlN粉末的水解速率,由于固体不影响平衡,所以最终溶液的pH是相同的。粒径为40 nm 的AlN粉末水解的变化曲线为 。
。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 硫酸、盐酸、氢氟酸均为强酸
D. 氯水、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法不正确的是( )
)是最简单的一种。下列关于该化合物的说法不正确的是( )
A.与环戊烯互为同分异构体
B.二氯代物超过两种
C.所有碳原子均处同一平面
D.1mol螺[2,2]戊烷充分燃烧需要7molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列各烷烃的分子式.
①烷烃A在同温同压下蒸气的密度是H2的43倍__________。
②烷烃B的分子中含有200个氢原子____________。
③1L烷烃C的蒸气完全燃烧时,生成同温同压下15L的水蒸气____________。
④0.1mol烷烃D完全燃烧,消耗标准状况下的O2 11.2L________________。
(2)乙烯是一种重要的化工原料.根据下列转化关系回答:
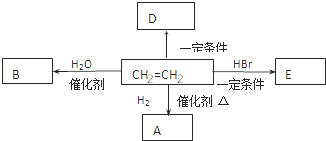
①乙烯分子中官能团的名称是_________ 。
②E的分子式是___________。
③乙烯转化成A的化学方程式是____________________ ,反应类型是_________ 。
④已知D是一种常见的高分子材料,写出它的结构简式__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是s能级和p能级的原子轨道图,试回答下列问题:
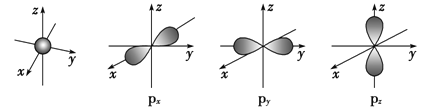
(1)s电子的原子轨道呈______形,每个s能级有______个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有________方向;元素X的名称是_______,它的氢化物的电子式是____________。若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为________,原子的电子排布图为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置甲、乙、丙都是铁与水蒸气反应的实验装置


下列说法不正确的是( )
A. 甲装置中氯化钙的作用是除去氢气中混有的水蒸气
B. 选用丙装置,实验结束时先移去酒精灯,再将导气管拿出水面
C. 用乙装置实验时,蒸发皿中产生大量肥皂泡,点燃肥皂泡发出爆鸣声
D. 三个装置相比较,乙装置简单、操作简便、节约原料、安全性好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,有关说法正确的是( )

A.铝罐将逐渐被腐蚀
B.碳粒和碳棒上发生的反应为O2+2H2O-4e-=4OH-
C.碳棒应与玩具电机的负极相连
D.该电池工作一段时间后碳棒和碳粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下,再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为
A.88%B.75%C.25%D.32%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com