
����Ŀ��(1)д�����и������ķ���ʽ��
������A��ͬ��ͬѹ���������ܶ���H2��43��__________��
������B�ķ����к���200����ԭ��____________��
��1L����C��������ȫȼ��ʱ������ͬ��ͬѹ��15L��ˮ����____________��
��0.1mol����D��ȫȼ�գ����ı�״���µ�O2 11.2L________________��
(2)��ϩ��һ����Ҫ�Ļ���ԭ�ϣ���������ת����ϵ�ش�
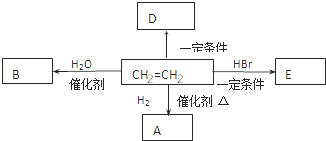
����ϩ�����й����ŵ�������_________ ��
��E�ķ���ʽ��___________��
����ϩת����A�Ļ�ѧ����ʽ��____________________ ����Ӧ������_________ ��
����֪D��һ�ֳ����ĸ߷��Ӳ��ϣ�д�����Ľṹ��ʽ__________________ ��
���𰸡�C6H14 C99H200 C14H30 C3H8 ̼̼˫�� C2H5Br CH2=CH2+H2![]() CH3-CH3 �ӳɷ�Ӧ
CH3-CH3 �ӳɷ�Ӧ ![]()
��������
(1)��ͬ��ͬѹ�£��ܶ�����Է������������ȣ���������ͨʽ�������ʽ��
�ڸ�������ͨʽ![]() ���㣻
���㣻
������ȼ��ͨʽ��������C�ķ���ʽ��
������ȼ��ͨʽ��������D�ķ���ʽ��
(2)��ϩ����̼̼˫������ˮ�����ӳɷ�Ӧ�����Ҵ������廯�ⷢ���ӳɷ�Ӧ���������顢�����������ӳɷ�Ӧ�������顢�����Ӿ۷�Ӧ���ɸ߷��ӻ��������ϩ��
(1)��ͬ��ͬѹ�£��ܶ�����Է������������ȣ�����A����Է���������86������ͨʽ��![]() ��12n+2n+2=86��n=6������ʽ��C6H14��
��12n+2n+2=86��n=6������ʽ��C6H14��
������ͨʽ![]() �������к���200����ԭ�ӣ���2n+2=200��n=99������ʽ��C99H200��
�������к���200����ԭ�ӣ���2n+2=200��n=99������ʽ��C99H200��
��![]() ��1L����C��������ȫȼ��ʱ������ͬ��ͬѹ��15L��ˮ��������n+1=15��n=14������C�ķ���ʽC14H30��
��1L����C��������ȫȼ��ʱ������ͬ��ͬѹ��15L��ˮ��������n+1=15��n=14������C�ķ���ʽC14H30��
��![]() ��0.1mol����D��ȫȼ�գ����ı�״���µ�O2 11.2L����
��0.1mol����D��ȫȼ�գ����ı�״���µ�O2 11.2L����![]() =5��n=3������D�ķ���ʽC3H8��
=5��n=3������D�ķ���ʽC3H8��
(2) ����ϩ���ӵĽṹ��ʽ��CH2=CH2�����й����ŵ�������̼̼˫����
����ϩ���廯�ⷢ���ӳɷ�Ӧ���������飬E�ķ���ʽ��C2H5Br��
����ϩ�����������ӳɷ�Ӧ�������飬��ϩת��������Ļ�ѧ����ʽ��CH2=CH2+H2![]() CH3-CH3����Ӧ�����Ǽӳɷ�Ӧ��
CH3-CH3����Ӧ�����Ǽӳɷ�Ӧ��
����ϩ�����Ӿ۷�Ӧ���ɾ���ϩ������ϩ�Ľṹ��ʽ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̴���ͭʱ�����õĿ���ԭ����Ҫ�ǿ�ȸʯ����Ҫȼ����ľ̿�����¶�1000������ұ���������漰�ķ�Ӧ�У�
��Cu2(OH)2CO3![]() 2CuO+CO2��+H2O��
2CuO+CO2��+H2O��
��2CuO+C![]() 2Cu+CO2����
2Cu+CO2����
��CuO+CO![]() Cu+CO2��
Cu+CO2��
��CO2+C![]() 2CO��
2CO��
(1)�����ֻ�����Ӧ�����������٢ڢܵķ�Ӧ���ͷֱ�Ϊ��___________����___________����___________��
(2)��Ӧ���У�____________����������Ӧ��__________������ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͪ�������п��������ԣ�6���ǻ���ͪ������ĺϳ�·�����£�
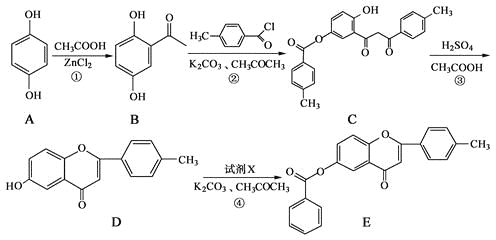
��ش��������⣺
��1��������B�еĺ���������Ϊ_____��_____�������ƣ���
��2����Ӧ�����漰���ķ�Ӧ������ˮ�ⷴӦ��_______��_______��
��3����Ӧ���м�����Լ�X�ķ���ʽΪC7H5OCl��X�Ľṹ��ʽΪ_______��
��4��B��һ��ͬ���칹����������������
���ܷ���������Ӧ����ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ��
��������4�ֲ�ͬ��ѧ�������⡣
д����ͬ���칹��Ľṹ��ʽ��___��
��5����֪�� ��
��
��������֪ʶ����������Ϣ��д����![]() ��CH3COOHΪԭ���Ʊ�
��CH3COOHΪԭ���Ʊ�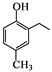 �ĺϳ�·������ͼ___�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ___�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
H2C��CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ڸ��١����ʵ�ˮ���к��������ᣬ����֪��������ֻ��C��H��O����Ԫ�ء�ȡ������19.2g������������ȫȼ�գ�����CO2��H2O�ֱ�Ϊ26.4g��7.2g���ֶԸ����ʽ������������ɻ�����������Է�������Ϊ192�����ú����������֪����������к��Щ�COOH�ͩ�OH����ش�
(1)ͨ�����㣬�ɻ��������ķ���ʽΪ_____��
(2)�����ú˴Ź���������������4�����շ壬������֮��Ϊ4��2��1��1���ۺ�������Ϣ��д��������Ľṹ��ʽ_____��
(3)���������л���C��һ�������·���������Ӧ������һ����Է�������Ϊ220���������ʡ�д��C���п��ܵĽṹ��ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ҷ�ͪ������ҽҩ�м��弰�����߹̻��������ɶ���������ͪ�����Ƶã���Ӧ�Ļ�ѧ����ʽ��װ��ͼ������װ��ʡ�ԣ���ͼ��
�ڷ�Ӧװ���У�����ԭ�ϼ��ܼ��������¼��Ȼ�������Ӧ�����������У���ȴ���ж������Ҷ�ͪ�ֲ�Ʒ��������70%�Ҵ�ˮ�� Һ�ؽᾧ�ᴿ���ؽᾧ���̣�
�����ܽ�������̿��ɫ�����ȹ�������ȴ�ᾧ��������ϴ��������
��ش��������⣺
(1)д��װ��ͼ�в������������ƣ�b_____��
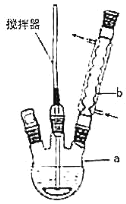
(2)���ȹ��˺���Һ��ȴ�ᾧ��һ������£�������Щ���������ڵõ��ϴ�ľ��壺_____��
A.������ȴ��Һ B.��ҺŨ�Ƚϸ� C.�����ܽ�Ƚ�С D.���������ܼ�
�����Һ�з������������ɲ���_____�ȷ����ٽ�����������
(3)�������õ���ֽӦ��_____����������������С����������©���ھ�����ȫ��С��ס�� �ձ��еĶ������Ҷ�ͪ����ת�벼��©��ʱ��������������ճ���������壬��ѡ��Һ�彫�����ϵľ����ϴ������ת�벼��©��������Һ������ʵ���_____��
A.��ˮ�Ҵ� B.����NaCl��Һ C.70%�Ҵ�ˮ��Һ D.��Һ
(4)���˹�����Ҫ��ʱ�۲�����ƿ��Һ��߶ȣ�����ﵽ֧�ܿ�λ��ʱӦ���еIJ���Ϊ_____��
(5)�����ؽᾧ�����е���һ��������ȥ�˲��������ʣ�_____��
(6)ijͬѧ���ñ���ɫ�ף�ԭ���Ͳ�����ֽ������ͬ�����ٷ�Ӧ���̣��ֱ��ڷ�Ӧ��ʼ������15min��30min��45min��60minʱ����ëϸ��ȡ��������������ɫ��չ����İߵ���ͼ��ʾ����ʵ�������±ȽϺ��ʵĻ���ʱ����_____��
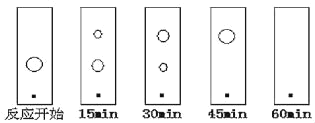
A.15min B.30min C.45min D.60min
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����0.200molL-1����ζ� 20.00mL 0.200 molL-1 �� NaY ��Һ����Һ��ˮ�ĵ���̶����������������仯��ͼ��ʾ�����Եζ���������Һ����仯�����������й�˵����ȷ���ǣ���֪ Ka(HY)=5.0��10-11]

A.��ѡȡ��̪��Ϊ�ζ�ָʾ��B.M ����Һ�� pH>7
C.Q ��ˮ�ĵ���̶���С��Kw<l0-14D.M�㣬c(Na+)=c (HY)+c (Y-)+c (Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ͳ��� AIN Ӧ��ǰ���㷺�������Ʊ����̵��о���Ϊ�ȵ㡣
(1)�����ʵ�����Ϊa mol �� Al2O3��N2 ������º����ܱ������У������¶ȷ�����Ӧ��2Al2O3(s)+2N2(g) ![]() 4AlN(s) +3O2(g) ��H>0��
4AlN(s) +3O2(g) ��H>0��
�����п���Ϊ��Ӧ�ﵽƽ����о���_________(����ţ���
A��������������ٸı�
B��2v��(N2)=3v��(O 2)
C����H ����
D�������������ѹǿ����
E��N2�������� O2 ��������Ϊ 2:3
������ʼѹǿΪp�ķ�Ӧ��ϵ�У�ƽ��ʱ N2��ת����Ϊ������������Ӧ��ƽ�ⳣ�� Kp__________(�������෴Ӧ����ij��� B ��ƽ��ѹǿ p(B)�������ʵ���Ũ��c(B)Ҳ�ɱ�ʾƽ�ⳣ��������Kp����p(B) =p����x(B) ��p��Ϊƽ����ѹǿ��x(B)Ϊƽ��ϵͳ��B�����ʵ�����������
��Ϊ�ٽ���Ӧ�Ľ��У�ʵ������������뽹̿����ԭ����____________��
(2)������ N2 ��һ���¶��¿�ֱ������ AlN�� �������� NH4Cl ����ɴٽ���Ӧ������������A1���벻ͬ���� NH4Cl��Ͼ��Ⱥ����ڳ� N2���ܱ������У������ȼ����Ʒ�� AlN����������[��(AlN)] ��ԭ������(NH4Cl)�ı仯��ͼ1��ʾ��ȼ�չ������¶���ʱ��仯��ͼ2��ʾ����
�ٹ��������У���(NH4Cl)�����ѡ����__________��
�ڽ��ͼ2���͵���(NH4Cl)����һ��ֵ����(AlN)���Լ��ٵ�ԭ��__________��

(3)AIN��ĩ�Ỻ������ˮ�ⷴӦ������Ϊ100 nm �� AlN ��ĩˮ��ʱ��Һ pH�ı仯��ͼ3 ��ʾ��

��AlN ��ĩˮ��Ļ�ѧ����ʽ��______________��
����ͬ�����£�����ͼ3�л�������Ϊ40 nm ��AlN��ĩˮ��ı仯����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�����빤ũҵ�������ճ����������ء���ҵ��̼���ƴ����ú����Ƽ��ȡ������̼������Ʒ��������������NaCl�������ⶨ̼������Ʒ��Na2CO3������������ij̽����ѧϰС��ֱ����������ʵ�鷽����
����һ������������
(1)��һ����������Ʒ�ܽ����������CaCl2��Һ�������ó���________(���������)��ϴ�ӡ���ɡ�������ϴ�ӳ����IJ�����________________________________________.
�����������������
(2)����ͼ��ʾװ�ã���һ����������Ʒ���������ᷴӦ�����ⶨ����CO2����������Ϊ��ʹ�������ȷ��B�е���Һ��ò���________(����ĸ)��
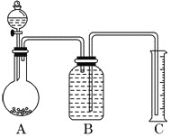
a������̼������Һ b������̼��������Һ
c����������������Һ d���Ȼ�����Һ
��ѡ�ø���Һ��ʵ������Ȼ����ȷ��ԭ����________________________________
�������������������
(3)������ͼ��ʾװ�ã���һ����������Ʒ��������ϡ���ᷴӦ��ͨ��������Ӧǰ��ʢ�м�ʯ�ҵĸ���ܵ������������������������Ʒ�Ĵ��ȡ�
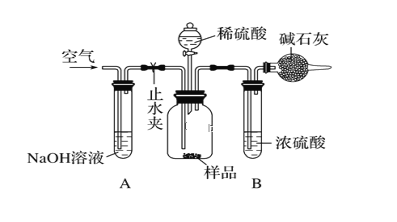
��ʵ��IJ������裺
���ڸ������װ����ʯ�ң�����Ϊm1g����ȡng��Ʒװ����ƿ�С��ۼ��װ�õ������ԡ��ܻ���������������ӣ��ٳ������������Ϊm2g���ݹر�ֹˮ�С���ֹˮ�С���������ϡ���������ٲ�������Ϊֹ������������������
��.��ȷ�IJ���˳����(�����)���ۡ�_____���ޡ�_____���ݡ�________���ߡ�________������
��.�ڲ������У�Ҫ����������������ӣ����������������________________��װ�� B��������__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ�����������������ǵ�ԭ������������֮��Ϊ17������W��X��Y����Ԫ�صļ����ӵĺ�������Ų���ͬ���ҿ��γɽṹ��ͼ��ʾ�Ļ��������˵����ȷ����( )
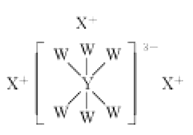
A.X��Y��Z������������Ӧˮ��������֮����ܷ�Ӧ
B.X��Z�γɵĻ����������ˮ�ĵ���
C.W�ļ���̬�⻯������ȶ��Ա�Z����
D.ԭ�Ӱ뾶�� Z>Y>X>W
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com