
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1mol![]() 发生氧化还原反应时,转移的电子数目一定为2NA
发生氧化还原反应时,转移的电子数目一定为2NA
B.向含有1mol![]() 的溶液中通入足量的氯气完全反应时,转移的电子数目为2NA
的溶液中通入足量的氯气完全反应时,转移的电子数目为2NA
C.常温常压下,14g由![]() 与
与![]() 组成的混合气体含有的原子数目为NA
组成的混合气体含有的原子数目为NA
D.![]() 的浓硫酸与足量铜在加热条件下反应,生成
的浓硫酸与足量铜在加热条件下反应,生成![]() 分子的数目为0.46NA
分子的数目为0.46NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2008年又是一个奥运年,兴奋剂问题再次受到广泛关注。心酮胺是治疗心脏疾病的一种药物,是国际足联批准使用的药品,它具有如图所示结构筒式,下列关于心酮胺的描述,不正确的是( )
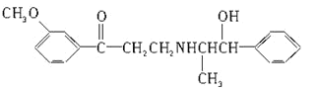
A.能够发生加成反应的官能团有两种
B.能够发生水解反应
C.当1mol心酮胺和H2发生加成反应时最多消耗7mol H2
D.能够与浓硝酸和浓硫酸的混合液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,气体密度不变
④恒温恒压时,充入惰性气体,平衡不移动
⑤加入催化剂,B的平衡转化率提高
A.①②B.②C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
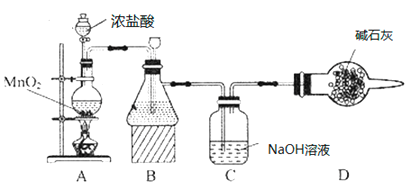
(1)该学习小组按如图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
已知:①饱和NaClO溶液pH为11;②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8。回答下列问题:
①装置B盛装的试剂是___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中C瓶溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的锥形瓶中发生反应的离子方程式为_________。
②滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成甲醇、二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1 kJ/mol
CO(g)+3H2(g) △H1=+206.1 kJ/mol
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H2=+247.3 kJ/mol
2CO(g)+2H2(g) △H2=+247.3 kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
请回答下列问题:
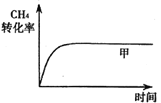
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示:

则反应前5min的平均反应速率v(H2)=______。10min时,改变的外界条件可能是_______(填代号)。
A.压缩体积 B.增大体积 C.升高温度 D.加入催化剂
(2)如图所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。
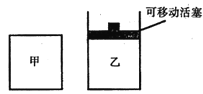
已知甲容器中CH4的转化率随时间变化的图像如图所示,请在图中画出乙容器中CH4的转化率随时间变化的图像_______。
(3)反应③中△H3=________。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是________(填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(4)800K时向下列三个密闭容器中各充入2 mol H2、1 mol CO,发生反应:2H2(g)+CO(g)CH3OH(g) △H<0,若三容器初始体积相同,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
甲.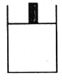 乙.
乙.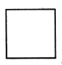 丙.
丙.
①达到平衡时,平衡常数K(甲)________K(乙);K(乙)________K(丙)(填“>”、“<”或“=”)。
②达到平衡时H2的浓度c(H2)(甲)________c(H2)(乙);c(H2)(乙)________c(H2)(丙)(填“>”、“<”或“=”)。
(5)在以甲醇为燃料的电池中,电解质溶液为碱性,负极的电极反应式为_________,甲醇应用于燃料电池比甲醇直接用作燃料燃烧的优点是_______(回答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
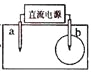
A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用![]() (熔点2045℃)和冰晶石(
(熔点2045℃)和冰晶石(![]() )混合熔融后电解制得。请回答下列问题:
)混合熔融后电解制得。请回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,其原因是__________,冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,请写出铝与V2O5在高温下反应的化学方程式:___________。
(2)将![]() 液和
液和![]() 溶液混合制取
溶液混合制取![]() 。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
(3)下列关于铝元素的叙述不正确的是__________(填序号)。
A.铝是人类最早使用的金属
B.镁铝合金既可完全溶于过量的盐酸,又可完全溶于过量的NaOH溶液
C.氢氧化铝是一种两性氢氧化物,既能溶于盐酸又能溶于NaOH溶液
D.铝是人体必需的微量元素之一,因此在生活中人们应尽量使用铝制炊具和餐具更有利于身体健康
(4)某工厂排放出有毒物质NOCl,它遇水就会生成![]() 。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的
。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的![]() 对人类健康会产生危害,为了降低水源中
对人类健康会产生危害,为了降低水源中![]() 的浓度,有研究人员建议在碱性条件下用铝粉将
的浓度,有研究人员建议在碱性条件下用铝粉将![]() 还原为N2,此时铝主要以
还原为N2,此时铝主要以![]() 的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的
的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的![]() 在标况下的体积约为_______L。
在标况下的体积约为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1) N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为______。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-=2NO2-+H2O;2NO2+2OH-=NO3-+NO2-+H2O;
①下列措施能提高尾气中NO和NO2去除率的有______(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是______(填化学式);吸收后排放的尾气中含量较高的氮氧化物是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com