
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是
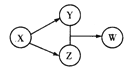
A | B | C | D | |
X | HCl | Na202 | Na2C03 | Al |
Y | FeCl2 | NaOH | CO2 | Na[Al(OH)4] |
Z | Cl2 | Na2C03 | CaC03 | AlCl3 |
W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是
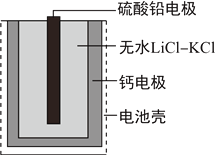
A. 放电时,电子由Ca电极流出
B. 放电过程中,Li+向PbSO4电极移动
C. 每转移0.2mol电子,理论上生成20.7 g Pb
D. 负极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酸雨的说法不正确的是( )
A. 空气中的SO2溶于水,最终形成酸雨
B. NO2或SO2都会导致酸雨的形成
C. pH<7的雨水不都是酸雨
D. 工业废水任意排放是造成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用电化学原理,回答下列问题:
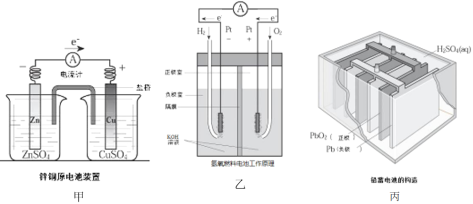
(1)上述三个装置中,负极反应物化学性质上的共同特点是_________。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________。
(3)乙中正极反应式为________;若将H2换成CH4,则负极反应式为_______。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验ⅰ中银作______极。
② 综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如图,下列说法不正确的是
![]()
A. 分子式为C8H7OCl
B. 在同一平面上的碳原子最多有8个
C. 1摩尔苯氯乙酮最多可与3摩尔氢气发生加成反应
D. 不存在与它同一类别的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于有气体参加的反应,一定能使化学反应速率加快的因素是( )
①扩大容器的容积 ②使用正催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大容器内的压强
A.②③B.②③④⑥C.②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.碳酸铵分解是吸热反应,根据焓判据判断能自发分解
B.多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大,越混乱,熵值越大
C.水总是自发地由高处往低处流,这是一个自发反应
D.室温下水结成冰是自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.人类能够有效利用氮气的主要途径是合成氨,生产化学肥料等。
完成下列填空:
(1)氮原子核外电子排布式为__________,其最外层有_______种运动状态不同的电子;氮气的电子式为______________;氨气分子的空间构型是______________。
(2)工业上常用醋酸亚铜氨溶液来吸收含有大量N2的高炉气体系中的CO,从而实现CO和N2的分离,反应的化学方程式如下:CH3COOCu(NH3)2 (aq) + CO(g)![]() CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K=________;欲使K值变大,可采取的措施是_______。
CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K=________;欲使K值变大,可采取的措施是_______。
吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的适当处理措施有
_____________(选填序号)。
a.适当升高温度 b.适当降低温度 c.增大压强 d.减小压强
(3)消除NH3对水体污染的重要方法是在一定条件下向水体中加入适量NaOH,这样能使NH3的脱除率增大,试用平衡移动原理解释其原因______________________________。
II.为实现CO2减排,合成氨工厂采用苯菲尔法脱碳。该方法是用碳酸钾溶液为吸收剂捕集混合气中的CO2得到富液,再高温加热富液使之分解释放出CO2 ,正常情况下再生的二氧化碳气体体积分数可达98.5%以上。
(4)某研究小组用200mL 1.5mol/L K2CO3溶液吸收了3.36L 的CO2(标准状况)形成富液,碳酸钾溶液吸收CO2的离子反应方程式为______________________________,该富液中的溶质是____________(填化学式),各离子的浓度关系正确的是_________。
a.c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
b.3c(K+)=4 c(CO32-)+4 c(HCO3-)+4c(H2CO3)
c.c(K+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com