
【题目】X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是
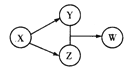
A | B | C | D | |
X | HCl | Na202 | Na2C03 | Al |
Y | FeCl2 | NaOH | CO2 | Na[Al(OH)4] |
Z | Cl2 | Na2C03 | CaC03 | AlCl3 |
W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
A. A B. B C. C D. D
【答案】B
【解析】
A、2HCl+Fe=FeCl2+H2↑,MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,2FeCl2+Cl2=2FeCl3,A正确;
MnCl2+Cl2↑+2H2O,2FeCl2+Cl2=2FeCl3,A正确;
B、2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2,但是NaOH与Na2CO3不能发生反应生成NaHCO3,B错误;
C、Na2CO3+2HCl=2NaCl+CO2↑+H2O,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,CaCO3+CO2+H2O=Ca(HCO3)2,C正确;
D、2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,2Al+3Cl2![]() 2AlCl3,3Na[Al(OH)4]+AlCl3=3NaCl+4Al(OH)3↓,D正确。
2AlCl3,3Na[Al(OH)4]+AlCl3=3NaCl+4Al(OH)3↓,D正确。
因此不符合该关系的是B。答案选B。


科目:高中化学 来源: 题型:
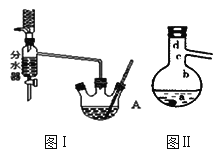
【题目】乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
Ⅰ.将混合液(18.5 mL正丁醇和13.4 mL过量乙酸,0.4 mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟。
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1 g乙酸正丁酯。
部分实验数据如下表所示:
化合物 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 溶解度(g)/(100 g水) |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(1)使用分水器(实验中可分离出水)能提高酯的产率,其原因是_______________.
(2)步骤Ⅱ中的操作顺序为____________(填序号),试剂X不能选用下列物质中的______________(填字母序号)。
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示)。
①当仪器连接好后,a.向相应的冷凝管中通冷凝水;b.加热蒸馏烧瓶,先后顺序是___________。(填“先a后b”或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的________(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质。
(4)该实验乙酸正丁酯的产率是_____________。(计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳纤维质轻、耐高温、有很高的抗拉强度与弹性,它与树脂、金属或陶瓷基体形成的复合材料广泛运用于航天飞机、火箭、导弹的外壳以及体育器具等。碳纤维的合成方法一般经历以下过程:
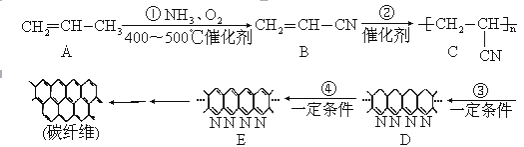
请回答下列问题:
(1)反应①的化学方程式:________________________________________________。
(2)反应②属于__________;反应④属于____________。(请选a、b、c、d填空)
a.加聚反应 b.缩聚反应 c.氧化反应 d.还原反应
(3)在化合物A、B、C、D、E中,所有原子可能在同一平面上的是____________。
(4)化合物E中碳元素的质量分数接近于________%。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
a.常温下0.1 mol·L-1 NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
d.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”);298K时,将10mL pH=3的亚硝酸溶液与10mL pH=11氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”)。
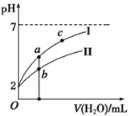
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是_______(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是__________。
(4)依据提供数据回答下列问题。
①NaH SO3在水溶液中的电离方程式为___________________。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1mol/L的醋酸溶液至0.01mol/L,随溶液的稀释,下列始终保持增大趋势的是( )
A. c(H+)×c(CH3COOH)B. c(CH3COO—)/c(H+)
C. Kw/c(H+)D. c(CH3COOH)/c(CH3COO—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法可以加快铁和稀硫酸的反应速率的是
A. 加入少量ZnCl2固体 B. 加入少量CuSO4固体
C. 加入少量水 D. 用98%的浓硫酸代替稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:浓硫酸易使有机物脱水,如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯时温度计水银球位置应在反应液的液面下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的反应方程式不正确的是
A. 碳酸钠溶液显碱性:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
C. 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2++S2-=CuS↓
D. 向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中变蓝:4H++4I-+O2=2I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com