
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:

已知信息如下:①RCH=CH2![]() RCH2CH2OH;
RCH2CH2OH;
② ;
;
③RCOOCH3  .
.
(1)A的结构简式为____,B →C的反应类型为___,C中官能团的名称为____,C→D的反应方程式为_____。
(2)写出符合下列条件的D的同分异构体_____(填结构简式,不考虑立体异构)。①含有五元环碳环结构;②能与NaHCO3溶液反应放出CO2气体;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子___,若有用“*”标出。
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备 的合成路线(其他试剂任选) ___。
的合成路线(其他试剂任选) ___。
【答案】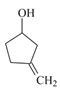 氧化反应 羧基、羟基
氧化反应 羧基、羟基 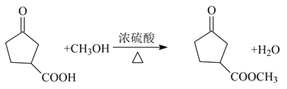
 、
、 和
和


【解析】
根据F的结构不难得知A含1个五元环,根据题目给的信息可知A中必定含有![]() 双键, 结合分子的不饱和度可知再无不饱和键,因此A的结构简式为
双键, 结合分子的不饱和度可知再无不饱和键,因此A的结构简式为 ,根据信息不难得出B的结构简式为
,根据信息不难得出B的结构简式为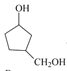 ,酸性高锰酸钾有氧化性,可将醇羟基氧化为羧基,因此C的结构简式为
,酸性高锰酸钾有氧化性,可将醇羟基氧化为羧基,因此C的结构简式为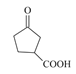 ,C到D的反应条件很明显是酯化反应,因此D的结构简式为
,C到D的反应条件很明显是酯化反应,因此D的结构简式为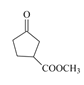 ,再根据题目信息不难推出E的结构简式为
,再根据题目信息不难推出E的结构简式为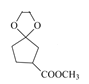 ,据此再分析题目即可。
,据此再分析题目即可。
(1)根据分析,A的结构简式为 ;B→C的过程是氧化反应,C中含有的官能团为羰基和羧基,C→D的反应方程式为
;B→C的过程是氧化反应,C中含有的官能团为羰基和羧基,C→D的反应方程式为 ;
;
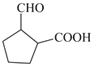
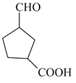
(2)根据题目中的要求,D的同分异构体需含有五元环、羧基和羟基,因此符合要求的同分异构体有三种,分别为 、
、 和
和 ;
;
(3)化合物F中含有手性碳原子,标出即可 ;
;
(4)根据所给信息,采用逆推法,可得出目标产物的合成路线为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中,正确的是:
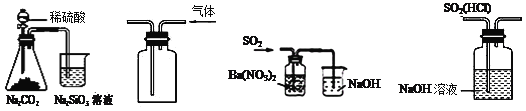
① ② ③ ④
A.图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.用图③所示实验装置制备BaSO3沉淀
D.图④装置可以用来除去SO2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。

已知: PCl3熔点为-112℃,沸点为75.5℃。易被氧化,遇水易水解。与Cl2反应生成PCl5。
(1)A中反应的化学方程式为__________________。
(2)B中所装试剂名称是___________________,E中碱石灰的作用是___________________。
(3)实验时,检查装置气密性后,向C装置的曲颈甑中加入红磷,打开止水夹K通入干燥的CO2,一段时间后,关闭K,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是____________________。CO2______(选填“能”或“不能”)用Cl2代替,理由是________________。
(4)D中烧杯中盛装__________,其作用是_______________。
(5)PCl3水解得到亚磷酸(分子式:H3PO3。二元弱酸),写出亚磷酸钠被浓硝酸氧化的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
A.体系压强不再发生变化
B.各组分的物质的量浓度不再改变
C.各组分的质量分数相等
D.反应速率vA∶vB∶vC∶vD=m∶m∶p∶q
查看答案和解析>>
科目:高中化学 来源: 题型:
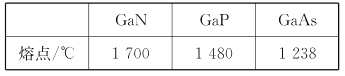
【题目】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]_______;与硒同周期的p区元素中第一电离能大于硒的元素有_____种;SeO3的空间构型是_______。
(2)根据元素周期律,原子半径Ga ___As,第一电离能Ga _____As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是______,硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4 、SiBr4,上述四种物质的沸点由高到低的顺序为__________,丁硅烯(Si4H8)中σ键与π键个数之比为___。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因___。
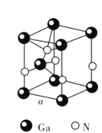
(5)GaN晶体结构如图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。
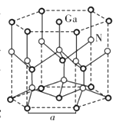
①晶体中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____。
②从GaN晶体中“分割”出的平行六面体如图所示。若该平行六面体的体积为![]() cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应![]() ,在密闭容器中达到平衡状态,下列说法正确的是( )
,在密闭容器中达到平衡状态,下列说法正确的是( )
A.体积不变,加少许![]() 化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
B.加压时(体积变小),将使正反应速率增大,逆反应速率减慢
C.体积不变,加少许![]() ,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
D.保持体积不变,升高温度,化学平衡正向移动,再达到平衡状态时混合气体密度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积相同的两个密闭容器M和N中,保持温度为150 ℃,向M容器中加入a mol HI,同时向N容器中加入b mol HI (a>b)。当反应2HI(g)![]() H2 (g) + I2 (g) 达到平衡后,下列说法正确的是
H2 (g) + I2 (g) 达到平衡后,下列说法正确的是
A.从反应开始到达到平衡,所需时间tM > tN
B.平衡时cM(I2) = c N(I2)
C.平衡时I2 蒸气在混合气体中的体积分数:M > N
D.HI的平衡分解率αM = αN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原理的应用,不正确的是( )
A.Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
B.用化学平衡移动原理能解释加催化剂,使N2和H2在一定条件下转化为NH3
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl 制备TiO2粉末
TiO2·xH2O↓+4HCl 制备TiO2粉末
D.CO32-+H2O![]() HCO3-+OH-用热的碱溶液清洗油污
HCO3-+OH-用热的碱溶液清洗油污
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com