
【题目】![]() 某有机物
某有机物![]() 和
和![]() 氧气在一密闭容器中充分燃烧,所得产物通过浓硫酸时使其增重
氧气在一密闭容器中充分燃烧,所得产物通过浓硫酸时使其增重![]() ,再通过足量灼热的氧化铜粉末,固体质量减少
,再通过足量灼热的氧化铜粉末,固体质量减少![]() ,最后再通过足量过氧化钠粉末,固体质量增加了
,最后再通过足量过氧化钠粉末,固体质量增加了![]() 。请回答:
。请回答:
(1)该化合物![]() 的分子式为_______。
的分子式为_______。
(2)简要写出推理过程_______。
【答案】C3H6O3 根据浓硫酸增重得n(H2O)=0.3mol
根据氧化铜固体减少的质量得n(CO)=0.1mol;
根据Na2O2可得混合气体中n(C)=0.3mol,因此n(CO2)=0.2mol,氧元素守恒得,有机物中n(O)=0.3mol
因此n(有机物):n(C):n(H):n(O)=1:3:6:3,分子式为C3H6O3。
【解析】
浓硫酸吸收燃烧产生的水,通过足量灼热的氧化铜粉末,燃烧产生的CO与氧化铜反应生成铜和二氧化碳,最后通入足量过氧化钠粉末,吸收产生的二氧化碳。
(1)浓硫酸增重5.4g,则燃烧产生水的质量为5.4g,物质的量为![]() ;通入氧化铜粉末,发生反应CO+CuO
;通入氧化铜粉末,发生反应CO+CuO![]() Cu+CO2,氧化铜减少1.6g,则燃烧产生CO的物质的量为
Cu+CO2,氧化铜减少1.6g,则燃烧产生CO的物质的量为![]() ,将产生二氧化碳通入过氧化钠粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,固体增重8.4g,则n(C)=
,将产生二氧化碳通入过氧化钠粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,固体增重8.4g,则n(C)= ![]() ,则燃烧产生二氧化碳的物质的量n(CO2)=0.2mol,氧元素守恒得,有机物中n(O)=0.3mol,因此n(有机物):n(C):n(H):n(O)=1:3:6:3,分子式为C3H6O3。
,则燃烧产生二氧化碳的物质的量n(CO2)=0.2mol,氧元素守恒得,有机物中n(O)=0.3mol,因此n(有机物):n(C):n(H):n(O)=1:3:6:3,分子式为C3H6O3。
(2)根据浓硫酸增重得n(H2O)=0.3mol
根据氧化铜固体减少的质量得n(CO)=0.1mol;
根据Na2O2可得混合气体中n(C)=0.3mol,因此n(CO2)=0.2mol,氧元素守恒得,有机物中n(O)=0.3mol;
因此n(有机物):n(C):n(H):n(O)=1:3:6:3,分子式为C3H6O3。


科目:高中化学 来源: 题型:
【题目】pc类似pH,是指稀溶液中离子的物质的量浓度的负对数。如溶液中某离子的物质的量浓度为![]() ,则该溶液中离子的pc=2。下列叙述正确的是( )
,则该溶液中离子的pc=2。下列叙述正确的是( )
A.用0.01mol·L-1的盐酸滴定某浓度的NaOH溶液,溶液的pH逐渐增大
B.向0.01mol·L-1的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pc(Ca2+)逐渐减小
C.0.01mol·L-1的Na2CO3溶液中,pc(Na+)=2pc(CO![]() )
)
D.常温下,纯水中pc(H+)+pc(OHˉ)=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产、国防等方面有广泛应用。
(1)基态铁原子的价电子排布式为________。
(2)Fe2+易被氧化成Fe3+,从微粒结构上分析其主要原因是________。
(3)原子坐标参数可表示晶胞内部各原子的相对位置。金属铁是体心立方晶系,其构型如图。其中原子坐标参数A(0,0,0)、B(1,0,0),则C原子的坐标参数为________。

若晶胞参数为apm,假定金属铁原子为等径的刚性小球且处于体对角线上的三个球相切,则铁原子的半径为________pm。
(4)FeO是离子晶体,其晶格能可通过下图的循环得到,则FeO的晶格能为________。
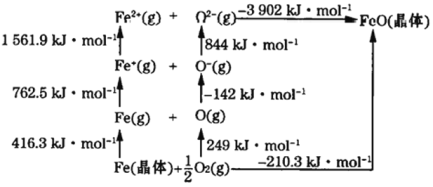
(5)下图是![]() 晶体的晶胞示意图。
晶体的晶胞示意图。
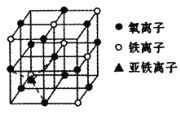
①晶胞中亚铁离子处于氧离子围成的_____空隙中(填空间结构)。
②若晶胞的体对角线长为anm,则Fe3O4晶体的密度为___![]() (阿伏加德罗常数用NA表示)
(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关用水杨酸和乙酸酐制备阿司匹林(乙酰水杨酸)的说法中不正确的是( )
A.制备阿司匹林的反应属于取代反应
B.待反应结束后向锥形瓶中加水,冰水浴中冷却结晶,减压过滤,用少量冷水淋洗锥形瓶收集所有晶体
C.粗产品中常混有聚合物杂质,可利用![]() 溶液溶解、过滤、洗涤、盐酸酸化、结晶等操作进行精制
溶液溶解、过滤、洗涤、盐酸酸化、结晶等操作进行精制
D.可用![]() 溶液检验阿司匹林中是否含有未反应完的水杨酸
溶液检验阿司匹林中是否含有未反应完的水杨酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向下列装置中缓慢通入气体X,分别进行关闭和打开活塞K的操作,则品红溶液和澄清石灰水中现象相同的一组是
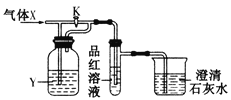
选项 | A | B | C | D |
X | NO2 | SO2 | Cl2 | CO2 |
Y(过量) | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面四个反应中,反应类型与其它三个不同的是
A.CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
B.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
C.C6H5OH+3Br2 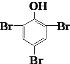 +3HBr
+3HBr
D.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(ZnS)=1.6×10-24;pM=-lgc(M2+)(M2+为Cu2+或Zn2+)。常温下,向10mL0.10mol·L-1CuCl2溶液中滴加0.10mol·L-1Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是

A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向上移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化硼![]() 是一种具有超高热导率的新型半导体材料,其制备原理为
是一种具有超高热导率的新型半导体材料,其制备原理为![]() 。下列说法错误的是( )
。下列说法错误的是( )
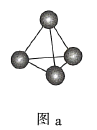

A.图a表示![]() 结构,
结构,![]() 分子中成键电子对与孤电子对的数目之比为3:1
分子中成键电子对与孤电子对的数目之比为3:1
B.图b表示晶态单质硼![]() 的基本结构单元,该基本结构单元为正二十面体
的基本结构单元,该基本结构单元为正二十面体
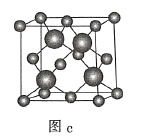
C.图c表示![]() 晶胞结构,
晶胞结构,![]() 原子的配位数为4
原子的配位数为4
D.该反应所涉及的元素中,I的原子半径最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
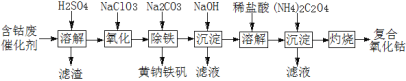
(1)用H2SO4溶解后过滤,得到的滤渣是____(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是____。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 =Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是____。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:____。
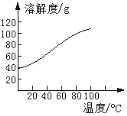
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com