
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
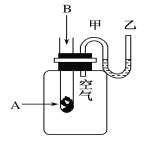
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量 ________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________。
【答案】(1)放热
(2)高
(3)化学反应 热能
(4)低
(5)2Al+6HCl===2AlCl3+3H2↑(或2Na+2H2O===2NaOH+H2↑或 NaOH+ HCl===NaCl+H2O
【解析】
试题分析:(1)U形管中甲处液面下降乙处液面上升,说明试管中的反应是放热反应使得瓶子里的压强增大,能推动U型管中的液面,使液面出现左低右高的现象;(2)反应物的总能量高于生成物的总能量时,反应为放热反应,故填写“高”(3)物质中的化学能通过化学反应转化成热能释放出来;(4)断裂化学键需要吸收的能量低于生成物形成化学键释放的能量时,反应为放热反应;(5)金属与酸反应为放热反应,故可以为2Al+6HCl===2AlCl3+3H2↑(或2Na+2H2O===2NaOH+H2↑或 NaOH+ HCl===NaCl+H2O


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题:
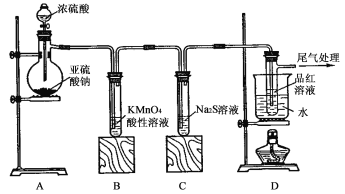
(1)装置A中盛放浓硫酸的仪器名称是____________________;
(2)实验过程中,装置B中发生的现象是 ,说明 SO2 具有 性;装置C中发生的现象是 ,说明 SO2 具有 性;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象: ;
(4)尾气可采用 溶液吸收,反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药——羟苯水杨胺,其合成路线如下。回答下列问题:

(1)羟苯水杨胺的化学式为 。1 mol羟苯水杨胺最多可以和 ____ mol NaOH反应。
(2)D中官能团的名称 。
(3)A→B反应所加的试剂是 。
(4)F在一定条件下发生缩聚反应的化学方程式为 。
(5) F存在多种同分异构体。F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是 。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
(6)F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应,且核磁共振氢谱显示4组峰,峰面积之比为1:2:2:1的同分异构体的结构简式(任写一种即可) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
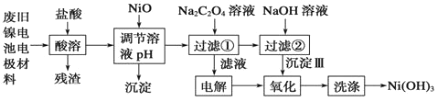
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。![]() H2O > NiC2O4
H2O > NiC2O4![]() 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一 ![]() Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一![]() Ni2O3+3 H2O
Ni2O3+3 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 实验室回收废水中苯酚的过程如图所示。下列分析错误的是( )


A. 操作Ⅰ中苯作萃取剂
B. 苯酚钠在苯中的溶解度比在水中的大
C. 通过操作Ⅱ苯可循环使用
D. 三步操作均需要漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献。一定条件下,在密闭容器中进行合成氨反应:N2(g) + 3H2(g)![]() 2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
A.N2、H2完全转化为NH3
B.N2、H2、NH3在容器中共存
C.反应已达到化学平衡状态
D.N2、H2、NH3的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。
试求:
① 该有机物的最简式 。
② 若符合该最简式的A物质可能不止一种,则它们之间的关系 (填序号)
A.一定互为同系物 B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③ 若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发
生酯化反应,且所有碳原子在同一链上,则A的结构简式为 。
(2)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知:
ⅰ.B分子中没有支链。
ⅱ.D能与碳酸氢钠溶液反应放出二氧化碳。ⅲ.D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。ⅳ.F可以使溴的四氯化碳溶液褪色。
① B可以发生的反应有 (选填序号)。
a.取代反应 b.消去反应 c.加聚反应 d.氧化反应
② D、F分子所含的官能团的名称依次是 、 。
③ 写出与D、E具有相同官能团的一种同分异构体的结构简式__________________。
④ 写出B和E反应生成A的化学方程式是: 。
⑤ 写出C与银氨溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
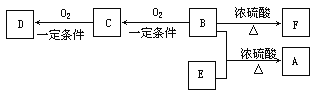
【题目】D、E为中学化学常见的金属单质且D常呈红棕色,F是一种黑色晶体。E与C的浓溶液在常温作用呈钝化现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图:

(1)已知1g E在B中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式____。
(2)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
A.氯水和KSCN溶液 B.氢氧化钠溶液 C.酸性KMnO4溶液
(3)用惰性电极电解一定浓度的A的水溶液,阳极反应式为_____________________,通电一段时间后,向所得溶液中加入8.0g D的氧化物后恰好恢复到电解前的浓度,则电解过程中收集到标准状况下的气体体积为多少升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com