
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
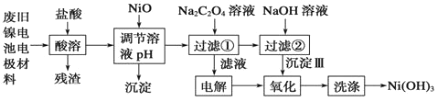
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。![]() H2O > NiC2O4
H2O > NiC2O4![]() 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一 ![]() Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一![]() Ni2O3+3 H2O
Ni2O3+3 H2O
【答案】(1)碳粉
(2)Fe(OH)3;Al(OH)3;
(3)Na2C2O4+NiCl2+2H2O=2NaCl+NiC2O4·2H2O↓
(4)NiC2O4+2OH-=Ni(OH)2↓+C2O42-(2分)8.0×105L.mol-1
(5)2H2O+2e-═H2↑+2OH-;(2分)2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-
(6)B
【解析】
试题分析:(1)碳粉不溶于水、酸,酸溶后所留残渣的主要成份为碳粉。
故答案为:碳粉;
(2)用NiO调节溶液的pH,先生成Fe(OH)3沉淀,然后生成Al(OH)3沉淀。
故答案为:Fe(OH)3;Al(OH)3;
(3)NiCl2可与Na2C2O4反应生成NiC2O4![]() 2H2O和NaCl,反应的化学方程式为NiCl2+Na2C2O4+2H2O═NiC2O4
2H2O和NaCl,反应的化学方程式为NiCl2+Na2C2O4+2H2O═NiC2O4![]() 2H2O↓+2NaCl。
2H2O↓+2NaCl。
故答案为:Na2C2O4+NiCl2+2H2O=2NaCl+NiC2O4![]() 2H2O↓;
2H2O↓;
(4)加入NaOH溶液,NiC2O4沉淀转化为Ni(OH)2,NiC2O4+2OH-Ni(OH)2+C2O42-,根据Ksp(NiC2O4):4.0×10-10,c(Ni2+)=c(C2O42-)= ![]() =2×10-5mol/L;
=2×10-5mol/L;
根据Ksp[Ni(OH)2]:5.0×10-16,c2(OH-)= ![]() =
= ![]() =2.5×10-11mol2/L2;
=2.5×10-11mol2/L2;
则该反应的平衡常数![]() =
= ![]() =8×105L/mol。
=8×105L/mol。
故答案为:NiC2O4+2OH-= Ni(OH)2↓+C2O42-;8.0×105L.mol-1;
(5)电解过程中阴极反应是水得电子产生氢气,电解NaCl溶液可以得到氧化性物质氯气,所以沉淀Ⅲ可被电解所得产物Cl2氧化生成Ni(OH)3,电极反应式为:2H2O+2e-═H2↑+2OH-;Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-。
故答案为:2H2O+2e-═H2↑+2OH-;2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-;
(6)A.根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,故A正确;B.充电时消耗氢氧根,阴极附近溶液的pH升高,故B错误;C.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,故C正确;D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,故D正确
故答案为:B。


科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为______________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图所示实验。
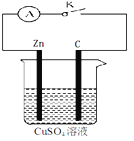
(1)打开K,观察到的现象为 ,
(2)关闭K,观察到的现象是 ,
此电池的负极的电极反应式为 ,
总反应式为 。
(3)关闭K,溶液中阳离子向 (填Zn或C)极运动,
外电路中,电子流动方向是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
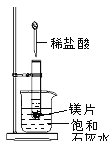
(1)实验中观察到的现象 。
(2)产生该现象的原因 。
(3)写出有关反应的离子反应方程 。
(4)有此推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是

A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀,该防护方法属于牺牲阳极的阴极保护法。
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
(1)夏天的食品易变霉,在冬天不易发生该现象 ;
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢 ;
(3)MnO2加入双氧水中放出气泡更快 .
Ⅱ:在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
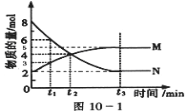
(1)比较t2时刻,正逆反应速率大小V正 V逆.(填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为: .
(3)t3时刻化学反应达到平衡,反应物的转化率为 .
(4)如果升高温度,则V逆 (填增大、减小或不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
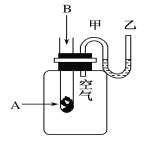
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量 ________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟九号”载人飞船与天宫一号目标飞行器首次完美交会对接,标志着我国成功实现首次载人空间交会对接。“长征”系列火箭用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出该反应的化学方程式:________________________________________
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量______(填“大于”、“小于”或“等于”)生成物的总能量,断开化学键________的总能量小于形成化学键________的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690pm和780pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com