
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为______________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为__________________。
【答案】31、(1)C8H8
(2)![]() +Br2 →
+Br2 →![]() (3)
(3)![]()
(4)![]() (5)
(5)![]()
【解析】试题分析:(1)1molA中n(C)=104×92.3÷12==8mol,n(H)=104×(192.3%)/1==8,则分子式为C8H8。
(2)该物质含有苯环,能与溴发生反应,说明A为苯乙烯,结构简式为![]() ,与溴发生加成反应生成
,与溴发生加成反应生成![]() ,反应的化学方程式为)
,反应的化学方程式为)![]() +Br2 →
+Br2 →![]() ;
;
(3)A中含有C=C,由![]()
![]()
![]() ,可知生成
,可知生成![]() ;
;
(4)一定条件下,A与氢气反应,可得乙苯或乙基环己烷,得到的化合物中碳的质量分数为85.7%,应为![]() ,其中ω(C)=12×8/12×8+16×100%=85.7%,答案为:
,其中ω(C)=12×8/12×8+16×100%=85.7%,答案为:![]() ;
;
(5)A含有C=C,可发生加聚反应生成聚苯乙烯,即![]() .
.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】将4 mol A 气体和2 mol B 气体在2 L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)![]() 2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
A. 当A、B、C物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B. 4s内用物质B表示的反应速率为0.075 mol·L-1·s-1
C. 达平衡后若通入一定量氦气,A的转化率降低
D. 达平衡后若升高温度,C的浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O晶体纯度,某学生取mg硫酸亚铁铵样品配置成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验。
![]()
(1)方案一的离子方程式为 ;
判断达到滴定终点的依据是 ;
(2)方案二的离子方程式为 ;若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为 ,如何验证你的假设 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00mL硫酸亚铁铵溶液进行该实验。
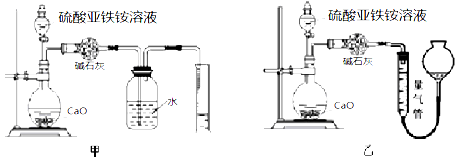
(3)①装置 (填“甲”或“乙”)较为合理,判断理由是
。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
A.水 B.饱和NaHCO3溶液 C.CCl4
②选用该装置会导致测量值总是偏大一些,分析原因 。
③若测得NH3的体积为VL(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为
(列出计算式即可,不用简化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (实验)某芳香烃A有如下转化关系:按要求填空:
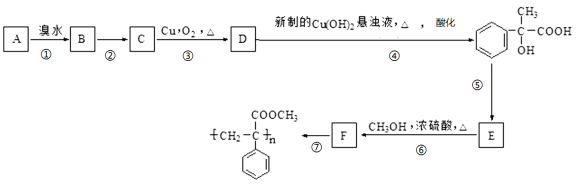
(1)写出D中所含官能团的名称 ,指出⑤的反应类型 。
(2)反应②的反应条件是 。
(3)写出A和F结构简式:A ;F 。
(4)写出反应③对应的化学方程式: 。
(5)写出D与新制Cu(OH)2悬浊液反应的化学方程式: 。
(6)E符合下列条件的同分异构体有多种,任写其中一种能同时满足下列条件的异构体的结构简式 。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 = Na2CO3 + CO2↑+ H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
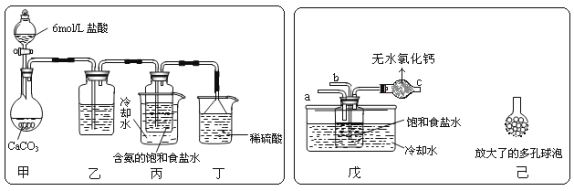
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:

请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气对氢气的相对密度为30,则E的分子式为_______________。
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为 。
(3)由B生成D、由C生成D的反应条件分别是_______________、_______________。
(4)由A生成B、由D生成G的反应类型分别是_______________、_______________。
(5)F存在于栀子香油中,其结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题:
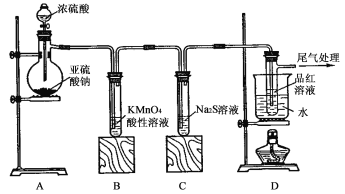
(1)装置A中盛放浓硫酸的仪器名称是____________________;
(2)实验过程中,装置B中发生的现象是 ,说明 SO2 具有 性;装置C中发生的现象是 ,说明 SO2 具有 性;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象: ;
(4)尾气可采用 溶液吸收,反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环(如左图):
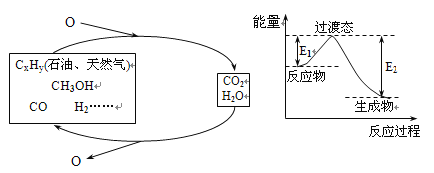
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气。右图是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ)分别是:
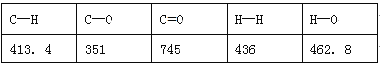
已知E1=8.2 kJ·mol-1,则E2=__________kJ·mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
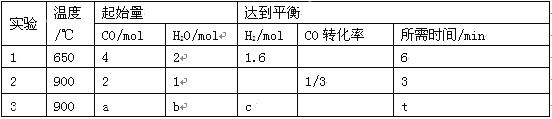
① 该反应的△H___________0(填“<” 或“>” )。
② 实验2条件下的平衡常数K= 。
③ 实验3中,若平衡时H2O的转化率为1/3,则a/b=______,c=____。
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正 V逆(填“<” ,“>” ,“=”)
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/L Na2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是____________________________。
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
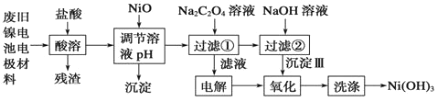
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。![]() H2O > NiC2O4
H2O > NiC2O4![]() 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一 ![]() Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一![]() Ni2O3+3 H2O
Ni2O3+3 H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com