
【题目】为测定硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O晶体纯度,某学生取mg硫酸亚铁铵样品配置成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验。
![]()
(1)方案一的离子方程式为 ;
判断达到滴定终点的依据是 ;
(2)方案二的离子方程式为 ;若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为 ,如何验证你的假设 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00mL硫酸亚铁铵溶液进行该实验。
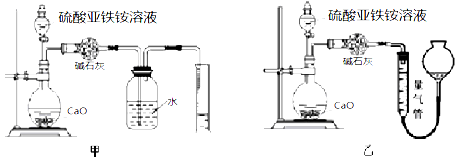
(3)①装置 (填“甲”或“乙”)较为合理,判断理由是
。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
A.水 B.饱和NaHCO3溶液 C.CCl4
②选用该装置会导致测量值总是偏大一些,分析原因 。
③若测得NH3的体积为VL(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为
(列出计算式即可,不用简化)。
【答案】(1)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分) 当滴加最后一滴酸性高锰酸钾溶液时,溶液刚好变为浅紫色,且半分钟内不再恢复原色,说明达到滴定终点(2分)
(2)SO42-+Ba2+=BaSO4↓(1分);Fe2+ 已被空气部分氧化(1 分)取少量硫酸亚铁铵溶液,加入少量 KSCN 溶液,若溶液变为血红色,说明 Fe2+ 已被空气部分氧化; (2 分)
(3)①乙(1 分) 氨气极易溶于水,甲装置无法排液体,甚至会出现倒吸(2 分)c(1 分)
②装置内的空气被量出导致测量值偏大(1 分)
③![]() (2 分)
(2 分)
【解析】
试题分析:
(1)在方案一中KMnO4具有强的氧化性,会把硫酸亚铁铵中的Fe2+氧化产生Fe3+,MnO4-被还原产生Mn2+,根据电子守恒、电荷守恒及原子守恒可得反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;MnO4-的水溶液是紫色的,Mn2+是无色的,在滴定达到终点时,锥形瓶内溶液由浅绿色变为浅紫色,且半分钟内不再恢复原色,就说明达到滴定终点。
(2)方案二中会发生复分解反应:SO42-+Ba2+=BaSO4↓;
若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+具有还原性,容易被空气部分氧化,但是SO42-的物质的量不变,故使其准确度下降;
验证Fe2+被氧化的假设的实验方法是少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(3)①测定NH4+的含量是通过测定NH3的体积的方法,由于氨气及容易溶于水,实验不能通过排水的方法测定其体积,并且甲装置无法排液体,甚至会出现倒吸故乙用排气的方法测定其体积较为合理;
氨气极易溶于水,所以量气管中最佳试剂是氨气不能溶解的液体物质,可以是四氯化碳,故选项c正确;
②装置内的空气被量出导致测量值偏大
③若测得NH3的体积为VL(已折算为标准状况下),n(NH3)=VL÷22.4L/mol=V/22.4mol,根据N元素守恒可知n[(NH4)2SO4·FeSO4·6H2O]=1/2 n(NH3)=V/(2×22.4)mol,所以则该硫酸亚铁铵晶体的纯度为
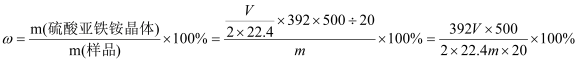


科目:高中化学 来源: 题型:
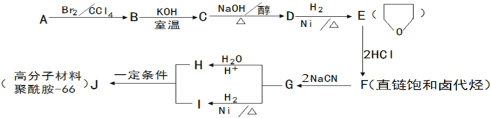
【题目】聚酰胺-66(尼龙-66)常用于生产帐篷、渔网、弹力丝袜等织物。可以利用以下路线来合成。D的核磁共振氢谱有两个峰。
已知: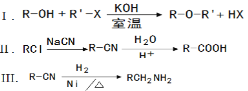
(1)1molA和1molH2在一定条件下恰好反应,生成饱和一元醇X,X中碳元素的质量分数约为65%,则X的分子式为 ,A分子中所含官能团的名称是 。
(2)B→C的反应类型是_________________。
(3)C→D的化学方程式为_______________________________________。
(4)F与氢氧化钠的乙醇溶液共热,得到有机产物Y
①Y的名称是_____________________。
②Y在一定条件下可以发生加聚反应得到以顺式结构为主的顺式聚合物,该顺式聚合物的结构简式为_____________________________。
(5)H和I反应生成J(聚酰胺-66)的化学反应方程式为_________________________。
为检验F中的官能团,所用试剂包括NaOH水溶液及 。
(6)同时满足下列条件的H的同分异构体有多种。写出其中一种同分异构体的结构简式(核磁共振氢谱有三个峰,面积比为4:4:2)________________________。
①只含一种官能团 ②1mol该物质与足量银氨溶液反应,生成4molAg
(7)已知: ![]()
![]()
写出以苯酚和HCHO为原料制备![]() 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着能源危机的加剧,我国也在大力推广新一代乙醇燃料,广西是我国甘蔗产量主产区之一,乙醇可以从甘蔗中提炼加工出来,乙醇除用作燃料外,还可以用它合成其他有机物。下面是以乙醇为起始原料的转化关系,请回答相关问题。
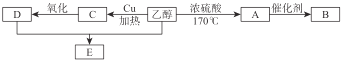
①B在日常生活中常用来作食品包装袋,但往往会带来环境问题。
写出A→B的化学方程式: 。
②写出乙醇→A的化学方程式: 。
③写出乙醇→C的化学方程式: 。
④写出E的方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液的pH、体积相同的盐酸和醋酸两种溶液,下列叙述错误的是
A.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH少
B.它们分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的n(Cl-)= n(CH3COO-)相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修 2—化学与技术]Ⅰ下列说法不正确的是
A.明矾、漂白粉、臭氧的净水原理相同
B.“血液透析”的原理利用了胶体的性质
C.食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮
D.煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾
Ⅱ水是一种重要的自然资源,是人类赖以生存不可或缺的物质。 水质优劣直接影响人体健康。 海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。 据此,回答下列问题:
(1)天然水灾净化处理过程中需要加入的混凝剂,我们常用的混凝剂有明矾、硫酸铝、硫酸铁,其净水作用的原理是 。
(2)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将 。
(3)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。 蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (选填“物理变化”或“化学变化”)。
(4)海水除了可以得到淡化水外,还可提取多种化工原料。由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①
(5)海水电解制得的氢气用于合成氨,某合成氨厂生产流程图如下

①第(1)个设备中先把N2和H2压缩的目的是 。
②在第(3)个设备中用冷却的方法分离出 ,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。

关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同
D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
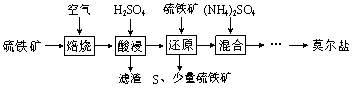
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.20 | 3.50 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为______________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图所示实验。
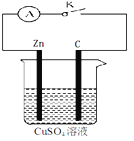
(1)打开K,观察到的现象为 ,
(2)关闭K,观察到的现象是 ,
此电池的负极的电极反应式为 ,
总反应式为 。
(3)关闭K,溶液中阳离子向 (填Zn或C)极运动,
外电路中,电子流动方向是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com