
【题目】[选修 2—化学与技术]Ⅰ下列说法不正确的是
A.明矾、漂白粉、臭氧的净水原理相同
B.“血液透析”的原理利用了胶体的性质
C.食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮
D.煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾
Ⅱ水是一种重要的自然资源,是人类赖以生存不可或缺的物质。 水质优劣直接影响人体健康。 海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。 据此,回答下列问题:
(1)天然水灾净化处理过程中需要加入的混凝剂,我们常用的混凝剂有明矾、硫酸铝、硫酸铁,其净水作用的原理是 。
(2)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将 。
(3)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。 蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (选填“物理变化”或“化学变化”)。
(4)海水除了可以得到淡化水外,还可提取多种化工原料。由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①
(5)海水电解制得的氢气用于合成氨,某合成氨厂生产流程图如下

①第(1)个设备中先把N2和H2压缩的目的是 。
②在第(3)个设备中用冷却的方法分离出 ,其目的是 。
【答案】ⅠAC
Ⅱ(1)铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体粒子,使其下沉,达到净化目的 ;
(2)水中胶体及悬浮物沉淀下来,而水的软化是降低水中的钙离子和镁离子;
(3)物理变化;
(4)D ;
(5)①使平衡向生成氨的方向移动;
②液态氨 ;
③使平衡右移,提高N2和H2的平衡转化率。
【解析】
试题分析:
Ⅰ、明矾中铝离子水解生成胶体,利用吸附性净化水,而漂白粉、臭氧具有强氧化性,可用于水的杀菌消毒,净水原理不同,故 A 错误;血液为胶体分散性,不能透过半透膜,而小分子、离子等可透过,则“血液透析冶的原理利用了胶体的性质,故 B 正确;硅胶具有吸水性,铁粉具有还原性,所以食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质,故 C 错误;煤炭燃烧、机动车尾气、建筑扬尘等均产生固体颗粒物,雾霾与空气中固体颗粒物,故 D 正确。
Ⅱ、(1)混凝剂是吸附水中的微小悬浮颗粒,并破坏天然水中的其他带异电的胶体粒子,凝聚成较大的颗粒,而快速沉降达到净化目的。因此要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,故答案为:铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的;(2)水的净化是用混凝剂将水中胶体及悬浮物沉淀下来,如明矾中铝离子水解生成胶体,使水中胶体及悬浮物沉淀下来,而水的软化为降低水中钙、镁离子浓度,故答案为:水中胶体及悬浮物沉淀下来,而水的软化是降低水中的钙离子和镁离子;(3)蒸馏是依据混合物中各组分沸点不同而分离的一种方法,适用于除去易挥发、难挥发或不挥发杂质,所以蒸馏是物理变化。(4)因海水中MgCl2的浓度较小,所以要经过富集这一过程:先加熟石灰形成沉淀:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,然后将沉淀过滤,接着将Mg(OH)2沉淀转化为MgCl2:Mg(OH)2+2HCl═MgCl2+2H2O,这样就实现了MgCl2富集,将溶液蒸发结晶得到六水合氯化镁晶体(MgCl26H2O)(这步是为了得到纯净的MgCl2),又因MgCl2易水解,为防止MgCl2水解的水解,加热六水合氯化镁晶体必须在HCl氛围下中进行:MgCl26H2O![]() MgCl2+6H2O.故答案为:②④③⑤①,选D;(5)①第(1)个设备中先把N2和H2压缩,可使压强增大,有利于使平衡向生成氨气的方向移动,故答案为:使平衡向生成氨气的方向移动;②在第(3)个设备中用冷却方法分离出液氨,生成物浓度降低,可使平衡向正向移动,提高转化率,故答案为:液氨;使平衡右移,提高氮气和氢气的转化率。
MgCl2+6H2O.故答案为:②④③⑤①,选D;(5)①第(1)个设备中先把N2和H2压缩,可使压强增大,有利于使平衡向生成氨气的方向移动,故答案为:使平衡向生成氨气的方向移动;②在第(3)个设备中用冷却方法分离出液氨,生成物浓度降低,可使平衡向正向移动,提高转化率,故答案为:液氨;使平衡右移,提高氮气和氢气的转化率。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】[化学~选修2:化学与技术]
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素。从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害。下图是用高炉烟尘制取硫酸锌的工业流程。

已知:①20℃时,0.1 mol.L-1的金属离子沉淀时的pH

②过二硫酸铵是一种强氧化剂。
![]()
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种) 。
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是 。
(3)加入MnO2的目的是 。
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式 。
(5)写出还原过程发生的主要反应的离子方程式 。
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是 。
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.利用N2和H2合成氨,目前工业的生产条件为:催化剂(铁触媒),温度(400~500℃),压强(30~50MPa),如图为流程示意图:
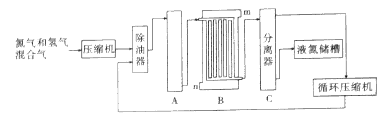
请回答下列问题:
(1)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是__________,__________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式__________,__________;
(2)设备A中含有电加热器、铁触煤和热交换器,设备A的名称__________,其中发生的化学反应方程式为__________;实际生产中采用400~500℃的高温,原因之一是__________,原因之二是__________。
(3)设备B的名称__________,其中m和n是两个通水口,入水口是__________(填“m”或“n”).不宜从相反方向通水的原因是__________;
(4)设备C的作用__________;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)![]() CO2(g)+H2(g),已知1000K时该反应的平衡常数K=1,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于__________。
CO2(g)+H2(g),已知1000K时该反应的平衡常数K=1,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】
NaCl是价廉且应用广泛的化工业原料,例如应用于纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。
(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代。
①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式_____________________。
②在联合制碱法中,纯碱工厂与______________工厂进行联合生产,以方便的获得原料_________________。
③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是_______________。
(2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀。
①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的___________性。
②请写出电解食盐水生产氯酸钠的化学方程式__________________。该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有____________________(请答出两点)。
(3)在肥皂的工业生成过程中,也要使用NaCl的目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:

已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成过程的反应产物中含有NaIO3,则在合成过程中消耗了3 mol I2,所生成 NaIO3的物质的量为 mol。
(2)写出还原过程中的离子方程式 ;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过 ℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质 (选填字母)。
A.FeCl2溶液 B.冰醋酸
C.KI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol·L -1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3 +I2===Na2S4O2 +2NaI),重复测定2次,所得的相关数据如下表:
测定 序号 | 待测液体积/ mL | 标准液滴定管起点读数/ mL | 标准液滴定管终点读数/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为 。
②加入A物质为 (填名称);滴定终点观察到的现象为 。
③计算该样品中NaI的含量为 。
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O晶体纯度,某学生取mg硫酸亚铁铵样品配置成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验。
![]()
(1)方案一的离子方程式为 ;
判断达到滴定终点的依据是 ;
(2)方案二的离子方程式为 ;若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为 ,如何验证你的假设 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00mL硫酸亚铁铵溶液进行该实验。
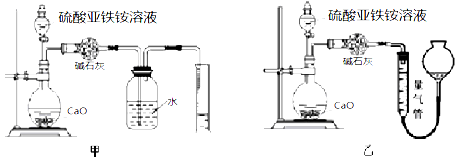
(3)①装置 (填“甲”或“乙”)较为合理,判断理由是
。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
A.水 B.饱和NaHCO3溶液 C.CCl4
②选用该装置会导致测量值总是偏大一些,分析原因 。
③若测得NH3的体积为VL(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为
(列出计算式即可,不用简化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种非金属元素X和Y,能分别形成常见气态氢化物Q和P,Q和P都是无色刺激性气味的气体,且都极易溶于水。常温常压下,Q的密度与空气的密度之比为0.59:1。标准状况下,P的密度为1.63 g/L。Q与P能1:1化合生成盐M。
(1)元素X在周期表中的位置为__________________,M的电子式为________________。
(2)氢化物Q极易溶于水的主要原因是________________。
(3)X元素与氢元素组成分子式为HX3的化合物,该化合物能与Q以1:1化合生成盐W,盐W中阴离子的结构与CO2相似,写出该阴离子的结构式:________________。
(4)某化合物由氢元素与X、Y元素组成,分子式为XH2Y,在水中是一种缓释强效消毒剂,请用化学方程式表示其原因:_________。
(5)某化合物由硼元素与X元素组成,化学式为BX,有多种结晶形态,其中立方结晶被认为是目前已知最硬的物质,BX立方结晶高硬度的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 = Na2CO3 + CO2↑+ H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
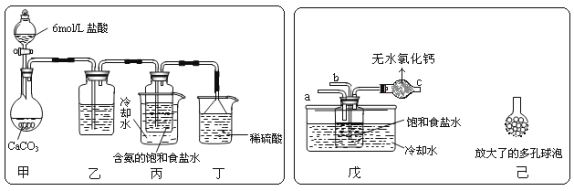
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1)A中反应的离子方程式为 ,B中Sn极附近会出现的现象_________ ,
C中Zn片上的的电极反应式为 ,发生 反应(填“氧化反应”或“还原反应”)。
(2)A、B、C中铁溶解的速率由快到慢的顺序是_________________ 。
(3)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如下图,电子由 极

流出(填元素符号),一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com