
【题目】【化学—选修2:化学与技术】
NaCl是价廉且应用广泛的化工业原料,例如应用于纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。
(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代。
①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式_____________________。
②在联合制碱法中,纯碱工厂与______________工厂进行联合生产,以方便的获得原料_________________。
③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是_______________。
(2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀。
①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的___________性。
②请写出电解食盐水生产氯酸钠的化学方程式__________________。该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有____________________(请答出两点)。
(3)在肥皂的工业生成过程中,也要使用NaCl的目的是_______________________。
【答案】(1)①NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3![]() Na2CO3+CO2↑+H2O②合成氨 NH3、CO2 ③CO2 NaCl
Na2CO3+CO2↑+H2O②合成氨 NH3、CO2 ③CO2 NaCl
(2)①强氧化 ②NaCl+3H2O![]() NaClO3+3H2↑ 需要加热恒温控制、没有离子交换膜
NaClO3+3H2↑ 需要加热恒温控制、没有离子交换膜
(3)加入食盐使肥皂析出 有利于肥皂的析出
【解析】
试题分析:(1)①氨气溶于水所得氨水呈碱性,比水更易吸收二氧化碳,向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3![]() Na2CO3+CO2↑+H2O;②在联合制碱法中,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微 小晶体,再煅烧制得纯碱产品,放出的二氧化碳气体可回收循环使用,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀 出氯化铵晶体,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,纯碱工厂与合 成氨工厂进行联合生产,以便获得原料NH3、CO2;③氨碱法的最大缺点在于原料食盐的利用率只有72%~74%,联合制碱法最大的优点是使食盐的利用率提高到96%以上,此外氨碱法与联合制碱法相比,CO2循环使用率也不高。
Na2CO3+CO2↑+H2O;②在联合制碱法中,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微 小晶体,再煅烧制得纯碱产品,放出的二氧化碳气体可回收循环使用,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀 出氯化铵晶体,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,纯碱工厂与合 成氨工厂进行联合生产,以便获得原料NH3、CO2;③氨碱法的最大缺点在于原料食盐的利用率只有72%~74%,联合制碱法最大的优点是使食盐的利用率提高到96%以上,此外氨碱法与联合制碱法相比,CO2循环使用率也不高。
(2)①处于高价的元素具有氧化性,氯酸钾中氯元素的化合价为+5价,在火柴、炸药、雷管、焰火的制造过程中分解生成氯化钾和氧气,氯元素化合价降低,表现强氧化性;②化合价升高的氯元素被氧化,化合价由-1价升高到+5价,化合价降低的氢元素被还原,化合价由+1价降低到0价,根据氧化还原反应得失电子数相等,反应为:NaCl+3H2O![]() NaClO3+3H2↑;电解氯化钠溶液控制条件可以得到氯酸钠和氢气,该过程中要控制好温度且不再需要离子交换膜,与氯碱工业制备氯气和氢氧化钠有较大的区别。
NaClO3+3H2↑;电解氯化钠溶液控制条件可以得到氯酸钠和氢气,该过程中要控制好温度且不再需要离子交换膜,与氯碱工业制备氯气和氢氧化钠有较大的区别。
(3)工业上制肥皂时,为了使肥皂和甘油充分分离,常向皂化锅中慢慢加入食盐颗粒,将高级脂肪酸钠从混合液中析出。


科目:高中化学 来源: 题型:
【题目】下图为甲同学设计的制取并检验C2H4性质的实验装置图。请回答有关问题:
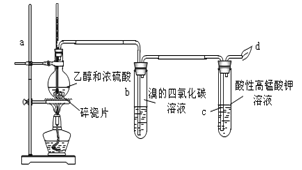
(1)写出上述制乙烯的反应的化学方程式: ,
(2)加入几片碎瓷片的目的是 ,
(3)加热时,使混合液温度迅速升高到170℃,是为了 ,
(4)实验过程观察到的现象为:
①Br2的四氯化碳溶液由 色变 ,
②酸性KMnO4溶液 。
(5)乙同学认为甲同学设计的实验如果仅从酸性KMnO4溶液褪色难以证明反应有乙烯生成,因为反应产生的乙烯中可能混有 气体也能使酸性KMnO4溶液褪色。写出此气体使酸性KMnO4溶液褪色的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体.A、B、C、D、E、F和OPA的转化关系如下所示:
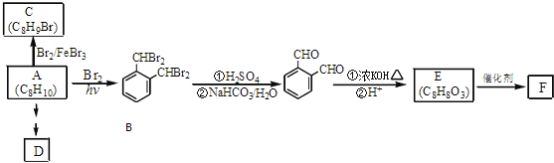
回答下列问题:
(1)A的化学名称是____________;
(2)由A生成B 的反应类型是____________,在该反应的副产物中,与B互为同分异构体的化合物的结构简式为____________;
(3)写出C所有可能的结构简式____________;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂.请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用结构简式表示合成路线____________;
(5)OPA的化学名称是____________,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为____________,该反应的化学方程式为____________;(提示![]() )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着能源危机的加剧,我国也在大力推广新一代乙醇燃料,广西是我国甘蔗产量主产区之一,乙醇可以从甘蔗中提炼加工出来,乙醇除用作燃料外,还可以用它合成其他有机物。下面是以乙醇为起始原料的转化关系,请回答相关问题。
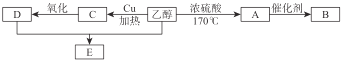
①B在日常生活中常用来作食品包装袋,但往往会带来环境问题。
写出A→B的化学方程式: 。
②写出乙醇→A的化学方程式: 。
③写出乙醇→C的化学方程式: 。
④写出E的方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡用作媒染剂和有机合成上的氯化催化剂,甲、乙为实验室制备四氯化锡的反应装置示意图,有关信息数据如下:

有关信息数据:①实验室制备四氯化锡的操作是将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中,再向反应器中缓缓通入干燥氯气;②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃,③无水四氯化锡暴露于空气中与空气中的水分反应生成白色烟雾,有强烈的刺激性。请回答下列问题:
Ⅰ、图甲是实验室制备干燥氯气的实验装置(夹持装置已略)
(1)A的仪器名称为__________,该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,B中发生反应的化学方程式为__________。
(2)装置C中饱和食盐水的作用是__________,同时装置C亦是安全瓶,能检测实验进行时是否发生堵塞,请写出发生堵塞时C中的现象:__________。
(3)试剂X可能为__________(填序号)
A无水氯化钙 B浓硫酸 C.碱石灰 D五氧化二磷
(4)用锡花代替锡粒的目的是__________。
Ⅱ.图乙是蒸馏SnCl4的装置
(1)图中,收集到的SnCl4中可能存在的副产物的化学式为__________。
(2)该装置尚有两处不当之处,它们分别是__________,__________;
(3)若实验中用去锡粉5,95g,反应后,Ⅱ中锥形瓶里收集到12.0gSnCl4。则SnCl4的产率为__________。(结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液的pH、体积相同的盐酸和醋酸两种溶液,下列叙述错误的是
A.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH少
B.它们分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的n(Cl-)= n(CH3COO-)相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修 2—化学与技术]Ⅰ下列说法不正确的是
A.明矾、漂白粉、臭氧的净水原理相同
B.“血液透析”的原理利用了胶体的性质
C.食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮
D.煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾
Ⅱ水是一种重要的自然资源,是人类赖以生存不可或缺的物质。 水质优劣直接影响人体健康。 海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。 据此,回答下列问题:
(1)天然水灾净化处理过程中需要加入的混凝剂,我们常用的混凝剂有明矾、硫酸铝、硫酸铁,其净水作用的原理是 。
(2)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将 。
(3)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。 蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (选填“物理变化”或“化学变化”)。
(4)海水除了可以得到淡化水外,还可提取多种化工原料。由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①
(5)海水电解制得的氢气用于合成氨,某合成氨厂生产流程图如下

①第(1)个设备中先把N2和H2压缩的目的是 。
②在第(3)个设备中用冷却的方法分离出 ,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
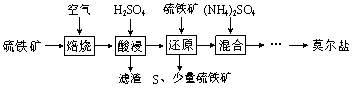
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.20 | 3.50 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数。下列说法正确的是( )
A.22.4L乙烷中含有的共价键数为7 NA个
B.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6 NA
C.0.1mol苯中含有碳碳双键的数目为0.3NA
D.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com