
【题目】NA代表阿伏加德罗常数。下列说法正确的是( )
A.22.4L乙烷中含有的共价键数为7 NA个
B.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6 NA
C.0.1mol苯中含有碳碳双键的数目为0.3NA
D.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】
NaCl是价廉且应用广泛的化工业原料,例如应用于纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。
(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代。
①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式_____________________。
②在联合制碱法中,纯碱工厂与______________工厂进行联合生产,以方便的获得原料_________________。
③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是_______________。
(2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀。
①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的___________性。
②请写出电解食盐水生产氯酸钠的化学方程式__________________。该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有____________________(请答出两点)。
(3)在肥皂的工业生成过程中,也要使用NaCl的目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 = Na2CO3 + CO2↑+ H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
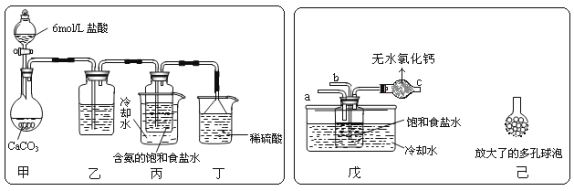
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题:
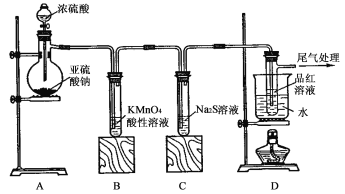
(1)装置A中盛放浓硫酸的仪器名称是____________________;
(2)实验过程中,装置B中发生的现象是 ,说明 SO2 具有 性;装置C中发生的现象是 ,说明 SO2 具有 性;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象: ;
(4)尾气可采用 溶液吸收,反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:

(1)① 反应II的化学方程式是______。
② 反应II其中一步反应为2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJmol-1
已知:![]()
![]()
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_______ kJ。
(2)反应III是利用右图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3 +3H2↑。
NCl3 +3H2↑。

① b接电源的_______极(填“正”或“负”)。
② 阳极反应式是_______。
(3)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环(如左图):
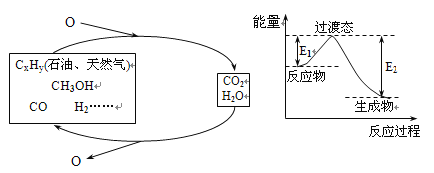
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气。右图是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ)分别是:
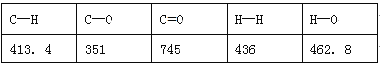
已知E1=8.2 kJ·mol-1,则E2=__________kJ·mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
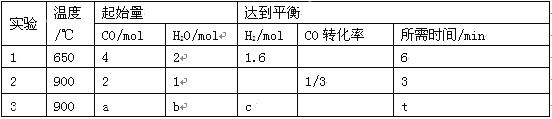
① 该反应的△H___________0(填“<” 或“>” )。
② 实验2条件下的平衡常数K= 。
③ 实验3中,若平衡时H2O的转化率为1/3,则a/b=______,c=____。
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正 V逆(填“<” ,“>” ,“=”)
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/L Na2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是____________________________。
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1)A中反应的离子方程式为 ,B中Sn极附近会出现的现象_________ ,
C中Zn片上的的电极反应式为 ,发生 反应(填“氧化反应”或“还原反应”)。
(2)A、B、C中铁溶解的速率由快到慢的顺序是_________________ 。
(3)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如下图,电子由 极

流出(填元素符号),一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药——羟苯水杨胺,其合成路线如下。回答下列问题:

(1)羟苯水杨胺的化学式为 。1 mol羟苯水杨胺最多可以和 ____ mol NaOH反应。
(2)D中官能团的名称 。
(3)A→B反应所加的试剂是 。
(4)F在一定条件下发生缩聚反应的化学方程式为 。
(5) F存在多种同分异构体。F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是 。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
(6)F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应,且核磁共振氢谱显示4组峰,峰面积之比为1:2:2:1的同分异构体的结构简式(任写一种即可) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。
试求:
① 该有机物的最简式 。
② 若符合该最简式的A物质可能不止一种,则它们之间的关系 (填序号)
A.一定互为同系物 B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③ 若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发
生酯化反应,且所有碳原子在同一链上,则A的结构简式为 。
(2)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知:
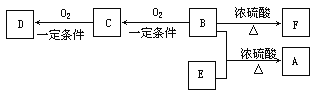
ⅰ.B分子中没有支链。
ⅱ.D能与碳酸氢钠溶液反应放出二氧化碳。ⅲ.D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。ⅳ.F可以使溴的四氯化碳溶液褪色。
① B可以发生的反应有 (选填序号)。
a.取代反应 b.消去反应 c.加聚反应 d.氧化反应
② D、F分子所含的官能团的名称依次是 、 。
③ 写出与D、E具有相同官能团的一种同分异构体的结构简式__________________。
④ 写出B和E反应生成A的化学方程式是: 。
⑤ 写出C与银氨溶液反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com