
【题目】两种非金属元素X和Y,能分别形成常见气态氢化物Q和P,Q和P都是无色刺激性气味的气体,且都极易溶于水。常温常压下,Q的密度与空气的密度之比为0.59:1。标准状况下,P的密度为1.63 g/L。Q与P能1:1化合生成盐M。
(1)元素X在周期表中的位置为__________________,M的电子式为________________。
(2)氢化物Q极易溶于水的主要原因是________________。
(3)X元素与氢元素组成分子式为HX3的化合物,该化合物能与Q以1:1化合生成盐W,盐W中阴离子的结构与CO2相似,写出该阴离子的结构式:________________。
(4)某化合物由氢元素与X、Y元素组成,分子式为XH2Y,在水中是一种缓释强效消毒剂,请用化学方程式表示其原因:_________。
(5)某化合物由硼元素与X元素组成,化学式为BX,有多种结晶形态,其中立方结晶被认为是目前已知最硬的物质,BX立方结晶高硬度的原因是________________。
【答案】(1)第二周期ⅤA族;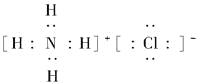
(2)液氨分子与水分子间存在氢键
(3)[N===N===N]-
(4)NH2Cl+H2O![]() HClO+NH3或NH2Cl+2H2O
HClO+NH3或NH2Cl+2H2O![]() HClO+NH3·H2O
HClO+NH3·H2O
(5)BN的立方结晶属于原子晶体,B、N以共价键结合形成空间网状结构
【解析】试题分析:Q的密度与空气的密度之比为0.59:1,所以Q的相对分子量为0.59×29=17,所以Q是氨气,标准状况下,P的密度为1.63g/L,所以P的相对分子质量为:1.63g/L×22.4L/mol=37,所以气态氢化物P是HCl,Q与P能1:1化合生成盐M是氯化铵,所以X是氮、Y是氯元素。
(1)元素氮质子数是7,两个电子层,最外层5个电子,所以在周期表中的位置为第二周期ⅤA族,氯化铵的电子式为: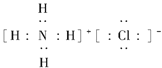 ,故答案为:第二周期ⅤA族;
,故答案为:第二周期ⅤA族;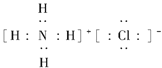 ;
;
(2)氢化物Q是氨气,氨分子极易溶于水的主要原因是液氨分子与水分子间存在氢键,故答案为:液氨分子与水分子间存在氢键;
(3)HN3的化合物,该化合物能与Q以1:1化合生成盐是NH4N3,阴离子为:N3-,结构与CO2相似,所以结构式为:[N═N═N]-,故答案为:[N═N═N]-;
(4)某化合物由氢元素与X、Y元素组成,分子式为XH2Y,即为:NH2Cl,与水发生水解反应,方程式为:NH2Cl+H2O![]() HClO+NH3或NH2Cl+2H2O
HClO+NH3或NH2Cl+2H2O![]() HClO+NH3H2O,故答案为:NH2Cl+H2O
HClO+NH3H2O,故答案为:NH2Cl+H2O![]() HClO+NH3或NH2Cl+2H2O
HClO+NH3或NH2Cl+2H2O![]() HClO+NH3H2O;
HClO+NH3H2O;
(5)BN立方结晶被认为是目前已知最硬的物质,是因为B、N以共价键结合形成空间网状结构,故答案为:BN的立方结晶属于原子晶体,B、N以共价键结合形成空间网状结构。


科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则
pC(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则
(1)该反应的正反应是__________热反应,且m+n__________p (填“>”、“<”或“=”)。
(2)增大压强时,B的转化率__________(填“增大”、“减小”或“不变”,下同),逆反应速率__________。
(3)若加入C(体积不变),则A的体积分数__________。
(4)若降低温度,则平衡时B、C的浓度之比c(C)/c(B)比值将________。
(5)若加入催化剂,该反应的反应热________。
(6)若B是有色物质,A、C均为无色物质,维持容器体积不变,充入氖气时,混合气体的颜色__________(填“变浅”、“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡用作媒染剂和有机合成上的氯化催化剂,甲、乙为实验室制备四氯化锡的反应装置示意图,有关信息数据如下:

有关信息数据:①实验室制备四氯化锡的操作是将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中,再向反应器中缓缓通入干燥氯气;②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃,③无水四氯化锡暴露于空气中与空气中的水分反应生成白色烟雾,有强烈的刺激性。请回答下列问题:
Ⅰ、图甲是实验室制备干燥氯气的实验装置(夹持装置已略)
(1)A的仪器名称为__________,该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,B中发生反应的化学方程式为__________。
(2)装置C中饱和食盐水的作用是__________,同时装置C亦是安全瓶,能检测实验进行时是否发生堵塞,请写出发生堵塞时C中的现象:__________。
(3)试剂X可能为__________(填序号)
A无水氯化钙 B浓硫酸 C.碱石灰 D五氧化二磷
(4)用锡花代替锡粒的目的是__________。
Ⅱ.图乙是蒸馏SnCl4的装置
(1)图中,收集到的SnCl4中可能存在的副产物的化学式为__________。
(2)该装置尚有两处不当之处,它们分别是__________,__________;
(3)若实验中用去锡粉5,95g,反应后,Ⅱ中锥形瓶里收集到12.0gSnCl4。则SnCl4的产率为__________。(结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修 2—化学与技术]Ⅰ下列说法不正确的是
A.明矾、漂白粉、臭氧的净水原理相同
B.“血液透析”的原理利用了胶体的性质
C.食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮
D.煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾
Ⅱ水是一种重要的自然资源,是人类赖以生存不可或缺的物质。 水质优劣直接影响人体健康。 海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。 据此,回答下列问题:
(1)天然水灾净化处理过程中需要加入的混凝剂,我们常用的混凝剂有明矾、硫酸铝、硫酸铁,其净水作用的原理是 。
(2)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将 。
(3)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。 蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (选填“物理变化”或“化学变化”)。
(4)海水除了可以得到淡化水外,还可提取多种化工原料。由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①
(5)海水电解制得的氢气用于合成氨,某合成氨厂生产流程图如下

①第(1)个设备中先把N2和H2压缩的目的是 。
②在第(3)个设备中用冷却的方法分离出 ,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g)![]() 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
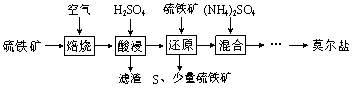
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.20 | 3.50 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,甲,乙所用的离子膜为同一类型。

①甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
②经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
③图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
(1)在酸式介质中,酸式电池的电极反应:负极: ,
正极: 。电解质溶液的pH (填“变大”、“变小”或“不变”)。
(2)在碱式介质中,碱式电池的电极反应:
负极: ,正极: 。
电解质溶液的pH (填“变大”、“变小”或“不变”)。
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是________。
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):

已知: (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
请回答:
(1)F蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量钠作用产生H2 22.4 L(标准状况),则F的分子式是__________________。
(2)G与F的相对分子质量之差为4,则G的性质是________(填字母)。
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是_______________________
(4)B的同分异构体较多,写出一种不含甲基能发生银镜反应的同分异构体结构简式:_________。
(5)A转化为B和F的化学方程式是_________________________。
(6)某烃分子H的碳原子数小于10,核磁共振氢谱只有一组峰, 在相同条件下也可发生类似B → C的反应并只生成一种有机物I,I的结构简式: _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com