
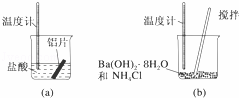
(1)某同学做如下实验,以检验反应中的能量变化.
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 热反应;(b)中温度降低,根据能量守恒定律,(b)中反应物的总能量应该 其生成物的总能量.
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银.其中(用序号填空):
能设计成原电池的反应是 .
考点:
探究吸热反应和放热反应;原电池和电解池的工作原理.
分析:
(1)探究化学反应中的能量变化时,温度升高,则反应放热;温度降低则反应吸热;吸热反应反应物总能量低于生成物,据此分析;
(2)能设计成原电池的反应必须是自发进行的放热的氧化还原反应,据此分析解答.
解答:
解:(1)通过实验测出,反应前后a烧杯中的温度升高,b烧杯中的温度降低,根据温度升高,反应放热,温度降低,反应吸热,所以Al跟盐酸的反应是放热反应,b是吸热反应,反应物总能量低于生成物,故答案为:放;低于;
(2)①氢氧化钠与硫酸反应,该反应不是氧化还原反应,所以不能设计成原电池,故错误;
②一氧化碳与氧气反应,该反应是放热反应且是自发的氧化还原反应,所以能设计成原电池,故正确;
③八水合氢氧化钡与氯化铵反应,该反应是吸热反应,所以不能设计成原电池,故错误;
④金属铜与硝酸银反应,该反应是放热反应且是自发的氧化还原反应,所以能设计成原电池,故正确,
故答案为:②④.
点评:
本题考查学生根据实验现象判断放热与吸热反应、原电池原理,注意放热反应反应物总能量高于生成物,断键吸收能量少于成键放出能量,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法错误的是( )
|
| A. | 乙醇和乙酸都是常用调味品的主要成分 |
|
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 |
|
| C. | 乙醇和乙酸都能发生氧化反应 |
|
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
FeSO4是一种精细化工产品,可用于治疗缺铁性贫血、制革、木材防腐等。制备步骤:①将3mol·L-1硫酸加入铁粉里,微热,搅拌使其充分反应;②趁热过滤;③在50℃左右蒸发、结晶,得到晶体——绿矾(FeSO4·7H2O)。回答下列问题:
(1)制备FeSO4溶液时一般不用较浓硫酸而用3mol·L-1硫酸的原因是___________
________________________________________________________________,反应时要求铁粉过量的理由是____________________________________________。
(2)检验步骤①所得溶液中金属阳离子的方法是__________________________
_________________________________________________。
(3)步骤②趁热过滤的原因是___________________________________。
(4)在空气中加热绿矾,固体质量与温度变化曲线如下图: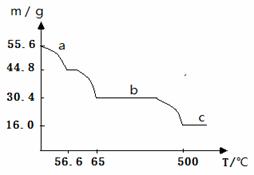
a曲线对应的反应化学方程式为___________________________________。
c曲线对应的物质化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
|
| A. | 同一元素不可能既表现金属性,又表现非金属性 |
|
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 |
|
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 |
|
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应速率的说法正确的是( )
|
| A. | 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 |
|
| B. | 100 mL 2 mol•L﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
|
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 |
|
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种共价化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.
(1)C的名称为
(2)写出表示非金属性C<D的化学方程式(任一个): .
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中,溶液由黄色逐渐变为浅绿色,该反应的离子方程式为 .
(4)请依据(3)中的反应,设计一个原电池.要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出负极反应式.负极反应式: .

查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E和F六瓶无色溶液,他们是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com