
【题目】25℃时,0.lmol/L的HA溶液中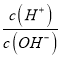 =1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是_______ 。
(2)HA的电离方程式是________。其中由水电离出的c(H+)=____mol/L。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是____ (填字母)。
A. 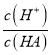 B.
B.  C. c(H+)与c(OH-)的乘积 D.c(OH-)
C. c(H+)与c(OH-)的乘积 D.c(OH-)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈________性,请用离子方程式解释其原因______________________。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/LNaHSO4,使溶液的pH为11。(混合溶液体积变化忽略不计),应加NaHSO4________mL。 (保留到小数点后一位)
【答案】 弱电解质 强电解质 HA![]() H++A- 10-12 B 碱 A-+H2O
H++A- 10-12 B 碱 A-+H2O![]() HA+OH- 81.8
HA+OH- 81.8
【解析】(1)25℃时,0.1mol/L的HA溶液中c(H+)/c(OH)=1010、c(H+)·c(OH-)=10-14,则该溶液中c(H+)=0.01mol/<0.1mol/L,所以HA是弱酸,则HA是弱电解质;0.01mol/L的BOH溶液pH=12,该溶液中c(OH-)=0.01mol/L=c(BOH),所以BOH是强碱,则BOH是强电解质;(2)HA是弱酸,在水溶液中存在电离平衡,电离方程式为A-+H2O![]() HA+OH-;该溶液中水电离出的c(H+)=c(OH)=1012 mol/L;(3)加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液中c(HA)、c(A-)减小,溶液温度不变,离子积常数不变,则溶液中c(OH-)增大;A.加水稀释促进HA电离,n(H+)增大、n(HA)减小,溶液体积相同,所以c(H+)/c(HA)增大,A错误;B.加水稀释促进HA电离,n(A-)增大、n(HA)减小,溶液体积相同,所以c(HA)/c(A)减小,B正确;C.温度不变,水的离子积常数不变,所以c(H+)与c(OH-)的乘积不变,C错误;D.根据以上分析可知c(OH-)增大,D错误;答案选B;(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合,二者恰好反应生成BA,BA为强碱弱酸盐,酸根离子水解导致溶液呈碱性,其水解方程式为A-+H2O
HA+OH-;该溶液中水电离出的c(H+)=c(OH)=1012 mol/L;(3)加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液中c(HA)、c(A-)减小,溶液温度不变,离子积常数不变,则溶液中c(OH-)增大;A.加水稀释促进HA电离,n(H+)增大、n(HA)减小,溶液体积相同,所以c(H+)/c(HA)增大,A错误;B.加水稀释促进HA电离,n(A-)增大、n(HA)减小,溶液体积相同,所以c(HA)/c(A)减小,B正确;C.温度不变,水的离子积常数不变,所以c(H+)与c(OH-)的乘积不变,C错误;D.根据以上分析可知c(OH-)增大,D错误;答案选B;(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合,二者恰好反应生成BA,BA为强碱弱酸盐,酸根离子水解导致溶液呈碱性,其水解方程式为A-+H2O![]() HA+OH-;(5)常温下pH=12的BOH溶液中c(OH-)=0.01mol/L,硫酸氢钠是强酸酸式盐,其完全电离生成钠离子、氢离子和硫酸根离子,相当于强酸性溶液,硫酸氢钠溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液呈碱性。设需要硫酸氢钠溶液的体积为xL,混合溶液中c(OH-)=(0.01mol/L×0.1L0.01mol/L×xL)/(0.1+x)L=0.001mol/L,解得x=0.0818L=81.8mL。
HA+OH-;(5)常温下pH=12的BOH溶液中c(OH-)=0.01mol/L,硫酸氢钠是强酸酸式盐,其完全电离生成钠离子、氢离子和硫酸根离子,相当于强酸性溶液,硫酸氢钠溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液呈碱性。设需要硫酸氢钠溶液的体积为xL,混合溶液中c(OH-)=(0.01mol/L×0.1L0.01mol/L×xL)/(0.1+x)L=0.001mol/L,解得x=0.0818L=81.8mL。


科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为![]()
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类已知的化合物中,数量最多的是( )
A.过渡元素形成的化合物
B.第ⅢA族元素形成的化合物
C.第ⅦA族元素形成的化合物
D.第ⅣA族元素形成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4LCCl4所含分子数为NA
B. 28g CO和N2的混合气体所含的原子数为NA
C. 2mol金属铁与足量的盐酸反应,共失去了 4NA个电子
D. 124g白磷(分子式为P4)所含分子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钾(K2S2O8) 在科研与工业上有重要用途。
(1)S2O82-的结构式为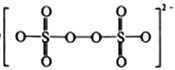 ,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。
①脱硫过程中,当氨吸收液的pH=6时,n(SO32-)∶n(HSO3-) =________。
[巳知:25℃时,Ka1(H2SO3)=1.5×10-2,K a2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,第2步反应的化学方程式为______________________________________;
一定条件下,NO去除率随温度变化的关系如右图所示。80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率,NO去除的平均反应速率:
v(NO) =____mol·L-1·min-1(列代数式)
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如右图所示。
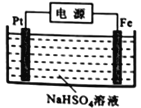
①电解时,铁电极连接电源的_________________极。
②常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
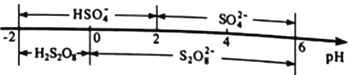
在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为_________,阳极的电极反应式为________________________。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在入住新装修的新房之前,下列做法错误的是
A. 紧闭门窗防止墙面干裂或变质 B. 适度开窗通风,充分进行室内外空气对流
C. 装修后空置一段时间后入住 D. 在各个房间适量放置吊兰,芦荟等植物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:A.石墨和金刚石 B. 35Cl和37Cl C.CH3CH=CHCH3和(CH3)2C=CH2 D.丁烷和新戊烷E. 
(1)属于同素异形体的是__________________
(2)属于同位素的是__________________
(3)属于同分异构体的是__________________
(4)属于同系物的是__________________
(5)属于同种物质的是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 代表阿伏加德罗常数的数值,下列说法正确的是 ( )
A. 18gH2O在标准状况下的体积是22.4L
B. 常温常压下28g以任意比组成的CO与N2混合气体中含有2NA 个原子
C. 5.6g Fe与足量盐酸反应,转移的电子数为0.3NA
D. 将0.1mol氯化钠溶于1L水中,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某些肉类的加工过程中需要用盐渍(把较多的食盐撒在肉制品表面,腌制一段时间),以防肉类变质.其原因是
A. 食盐中的氯离子有杀菌作用
B. 由于渗透而使肉质细腻
C. 浓盐水中氧气的含量少,致使细菌无法生存
D. 由于细菌细胞膜的渗透作用使细菌失水而死亡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com