
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。

【答案】 -744 kJ·mol-1 0.0875 (或7/80) 不 AC HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7(HSO3-的电离常数),所以显酸性 6H++ NO+ 5e- = NH![]() +H2O 32
+H2O 32
【解析】
本题考查盖斯定律、化学平衡常数计算、勒夏特列原理、电离平衡常数、水解平衡常数、水的离子积的关系等。
(1)由盖斯定律可知:①N2(g)+O2(g) ![]() 2NO(g),②2CO(g)+O2(g)
2NO(g),②2CO(g)+O2(g) ![]() 2CO2(g),②-①得出:△H=(-564-180)kJ·mol-1=-744kJ·mol-1;
2CO2(g),②-①得出:△H=(-564-180)kJ·mol-1=-744kJ·mol-1;
(2) ①2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始/mol: 0.4 0.4 0 0
变化/mol: 0.2 0.2 0.2 0.1
平衡/mol: 0.2 0.2 0.2 0.1,
p(NO)=p(CO)=p(CO2)= 20MPa×![]() =
=![]()
p(N2)= 20MPa×![]() =
=![]()
Kp=![]() =
=![]() =0.0875;根据①的分析,化学平衡常数K=5,再向容器中充入NO和CO2各0.3mol,此时的浓度商为仍为5,因此平衡不移动;②15min时,改变某一因素,NO的物质的量减少,说明平衡向正反应方向移动。增大CO的浓度,平衡向正反应方向移动,NO的物质的量减小,A项正确;正反应是放热反应,升温,平衡向逆反应方向移动,NO的物质的量增大,B项错误;减小容器的体积,相当于增大压强,平衡向正反应方向移动,NO物质的量减小,C项正确;加入催化剂,化学平衡不移动,D项错误;(3)HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7,电离平衡常数大于水解
=0.0875;根据①的分析,化学平衡常数K=5,再向容器中充入NO和CO2各0.3mol,此时的浓度商为仍为5,因此平衡不移动;②15min时,改变某一因素,NO的物质的量减少,说明平衡向正反应方向移动。增大CO的浓度,平衡向正反应方向移动,NO的物质的量减小,A项正确;正反应是放热反应,升温,平衡向逆反应方向移动,NO的物质的量增大,B项错误;减小容器的体积,相当于增大压强,平衡向正反应方向移动,NO物质的量减小,C项正确;加入催化剂,化学平衡不移动,D项错误;(3)HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7,电离平衡常数大于水解
平衡常数,说明溶液显酸性;(4)根据电解装置,NO和SO2转化为硫酸铵,说明NO转化成NH4+,即NO在阴极上发生NO+6H++5e-=NH4++H2O;阳极反应式为SO2+2H2O-2e-=4H++SO42-,根据得失电子数目守恒,因此有2NO~10e-~5SO2,求出SO2的质量为4.48×5×64/(2×22.4)g=32g。


科目:高中化学 来源: 题型:
【题目】某同学为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1mol某烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4L,同时得到16.2g水。
(1)该烃的摩尔质量为______________。
(2)该烃的分子式为____________________。
(3)该烃有一种可能的结构为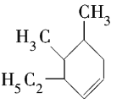 ,其系统命名为___________。
,其系统命名为___________。
(4) 属于______________(选填序号)。
属于______________(选填序号)。
a.环烃b.烷烃c.芳香烃d.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 聚乙烯不能使酸性KMnO4溶液褪色
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C. ![]() 和
和![]() 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===AlO![]() +2H2O+4NH
+2H2O+4NH![]()
B. 硫化钠的水解反应:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C. 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO![]() +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
D. 单质铜与稀硝酸反应:Cu+2H++2NO![]() ===Cu2++2NO↑+H2O
===Cu2++2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L苯中含C-H数目为0.6 NA
B.常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
C.常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内试剂均足量,部分夹持装置已省略)。
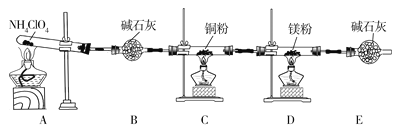
(1)在实验过程中发现C中铜粉由红色变为黑色,说明分解产物中有__(填化学式)。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为__。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是__。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
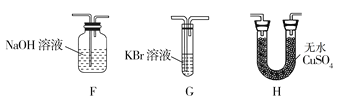
①按气流从左至右,装置的连接顺序为A→__→__→__。
②F中发生反应的离子方程式为__。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为___。
(6)在实验过程中仪器E中装有碱石灰的目的__;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__(填“偏大”“偏小”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是
A.已知中和热为57.3 kJ/mol:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ/mol
B.1 mol SO2与2 mol O2在某密闭容器中反应放出88 kJ热量,则反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H=-176 kJ/mol
2SO3(g) △H=-176 kJ/mol
C.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D.8 g 固体硫完全燃烧生成SO2,放出74kJ热量:S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种将电解饱和食盐水与电催化还原CO2相耦合的电解装置如图所示。下列叙述错误的是
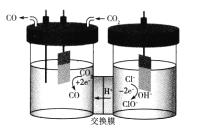
A.理论上该转化的原子利用率为100%
B.阴极电极反应式为![]()
C.Na+也能通过交换膜
D.每生成11.2 L(标况下)CO转移电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com