
【题目】将含有O2和CH4的混合气体置于盛有23.4 g Na2O2的密闭容器中,电火花点燃,反应结束,容器内的压强为零(温度150℃),将残留物溶于水,无气体产生,下列叙述正确的是
A.原混合气体中O2和CH4的体积比为2:1
B.残留物中只有Na2CO3
C.原混合气体中O2和CH4的物质的量之比为1:2
D.残留物只有Na2CO3和NaOH
【答案】CD
【解析】
将含有O2和CH4的混合气体置于盛有23.4g Na2O2的密闭容器中,电火花点燃反应为,CH4+2O2![]() CO2+2H2O;2CO2+2Na2O2=2Na2CO3+O2;2H2O+2Na2O2=4NaOH+O2;根据题意可知反应结束后,容器内的压强为零(150℃),说明无气体剩余,则甲烷、氧气全部反应,将残留物溶于水中,无气体产生说明无过氧化钠剩余,则23.4 g Na2O2全部反应,其物质的量n(Na2O2)=23.4 g÷78 g/mol=0.3 mol;根据上述三个反应得到:2CH4+O2+6Na2O2=2Na2CO3+8NaOH。
CO2+2H2O;2CO2+2Na2O2=2Na2CO3+O2;2H2O+2Na2O2=4NaOH+O2;根据题意可知反应结束后,容器内的压强为零(150℃),说明无气体剩余,则甲烷、氧气全部反应,将残留物溶于水中,无气体产生说明无过氧化钠剩余,则23.4 g Na2O2全部反应,其物质的量n(Na2O2)=23.4 g÷78 g/mol=0.3 mol;根据上述三个反应得到:2CH4+O2+6Na2O2=2Na2CO3+8NaOH。
A. 根据上述分析得到的反应可知,O2和CH4按照1:2恰好与0.3 mol Na2O2反应,无气体剩余,原混合气体中O2和CH4的体积比为2:1时,剩余甲烷,A错误;
B. 甲烷燃烧生成的气体有二氧化碳和水蒸气,所以和过氧化钠反应时残留物有Na2CO3和NaOH,B错误;
C. 根据上述分析得到的反应可知,O2和CH4按照1:2恰好与0.3 mol Na2O2反应,C正确;
D. 由题意结合分析得到的反应关系可知,残留物只有Na2CO3和NaOH,D正确;
故合理选项是CD。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】有关物质存在如图所示的转化关系,已知C、G、H为中学常见的单质,其中G 固态时呈紫黑色,C、H在通常状况下为气体,实验室常用E在B的催化加热下制单质H。
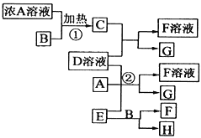
(1)写出B物质的名称 _______________________ ;
(2)写出①的化学反应方程式 ___________________________________________________ ;
(3)写出②的离子方程式_____________________________________________________________;
(4)在D溶液中通入C 后的溶液中,分离出G 的操作名称是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是______。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式______。比较碳、硅两种元素的非金属性强弱,可以通过比较______(填:化合物性质的差异)来判断
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是______
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)
a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)
a.c(CO)=3c(N2)
b.v (CO)=3v(N2)
c.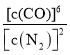 保持不变
保持不变
d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应如下:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
A. A的平均反应速率为 0.1 mol/(L·min)
B. 平衡时,C的浓度为 0.125 mol/L
C. 平衡时,B的转化率为 20%
D. 平衡时,容器内压强为原来的 0.8 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制烧碱所用盐水需两次精制。
第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
(1)过程Ⅰ除去的离子是_______________。
(2)检测Fe3+是否除尽的方法是____________________。
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因______________。
(4)除去Mg2+的离子方程式是________________。
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____________。
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:
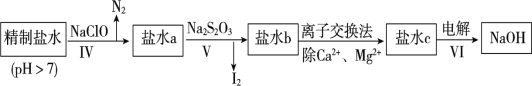
(6)过程Ⅳ除去的离子是__________________。
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年诺贝尔化学奖获得者赫克、伊智根岸(美)和铃木彰(日)在钯催化交叉偶联反应方面的研究,为化学家提供了更为精确、有效的工具,极大促进了制造复杂化学物质的可能性。已知一种钯催化的交叉偶联反应可以表示为:
![]()
下面是利用钯催化的交叉偶联反应,以烃A与苯为原料合成某个复杂分子L(相对质量不超过200)的过程,其中F在浓硫酸作用下可以发生两种不同的反应分别形成H和G。
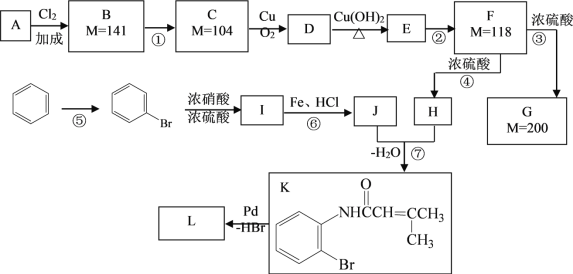
(1)写出反应的反应类型:④____________ ⑥________________ ;
(2)写出反应需要的无机反应物、反应条件:
①_______________,⑤_________________;
(3)根据要求完成下列两个空格:
用系统命名法给物质A命名:________________;
写出物质L的结构简式:__________________。
(4)写出下列反应的化学方程式:
C→D:_________________________;
F→G:_________________________。
(5)H有多种同分异构体,请写出一种符合下列条件的结构简式:_________。
i. 能发生水解反应 ii. 分子中只含有两个甲基 iii. 不含环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间的转化均能实现的是
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2(aq)![]() Cu(OH)2(s)
Cu(OH)2(s) ![]() Cu(s)
Cu(s)
C.MgCl26H2O(s) ![]() MgCl2(s)
MgCl2(s)![]() Mg(s)
Mg(s)
D.NH3(g)![]() NO(g)
NO(g)![]() HNO3(aq)
HNO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含锌矿渣中提取制备锌白(ZnO)有多种方法,其中氨一碳酸氢铵法的优点是成本低。请根据以下材料,回答问题:
材料1:某矿渣的主要成份为ZnO、Fe2O3、PbO、MnO、CuO、SiO2。
材料2:主要反应原理:ZnO+NH4HCO3+3NH3=Zn(NH3)4CO3 + H2O,类似的也可以生成[Cu(NH3)4] 2+、 [Pb(NH3)4]2+这样的络合离子,这些络合离子中的金属元素同样可以被置换出来,同时锰元素会随着金属锌一起进入浸出液中。
材料3:相关阳离子的氢氧化物的Ksp数据如表所示(室温):
阳离子 | Fe2+ | Mn2+ | Pb2+ | Fe3+ | Mn4+ | Pb4+ |
Ksp | 8.0×10-16 | 4.0×10-14 | 1.2×10-15 | 4.0×10-38 | 1.9×10-13 | 3.2×10-66 |
材料4:可选氧化剂与还原剂:
编号 | A | B | C | D |
氧化剂 | 氯气 | 35%过氧化氢 | 过氧化钠 | 酸性高锰酸钾溶液 |
还原剂 | 镁粉 | 铝粉 | 碳粉 | 锌粉 |
材料5:基本工艺(部分):
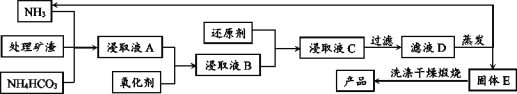
(1)加入氧化剂最好应选择材料4中的_______(填编号);后又加入还原剂的目的是还原溶液中的[Cu(NH3)4]2+、[Pb(NH3)4]2+等离子,请在材料4中选择合适的还原剂写出其中一个离子方程式_______.
(2)对滤液D的蒸发在工艺流程上也叫“蒸氨”,此过程中得到一种碱式盐沉淀物和两种气体,产生的气体可以在经过碱石灰处理后得到纯净而干燥的氨气。固体E经洗涤干燥后,灼烧得到产品,并产生水和CO2。则“蒸氨”过程中发生的化学反应方程式可表述为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com