
【题目】下列关于影响化学反应速率的条件的说法正确的是( )
A.增大压强一定能加快化学反应速率
B.使用催化剂对化学反应速率没影响
C.增加反应物的量一定能加速化学反应速率
D.升高温度,一般能加快化学反应速率
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下图为元素周期表截取的短周期的一部分,即四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是 ( )
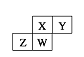
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物肯定为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氨水使酚酞溶液变红是因为溶液中NH3H2O电离出OH-
B.KNO3溶于水电离出K+和NO3-
C.电离时生成的阳离子有H+的化合物不一定是酸
D.SO2溶于水能导电,所以SO2是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。

(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
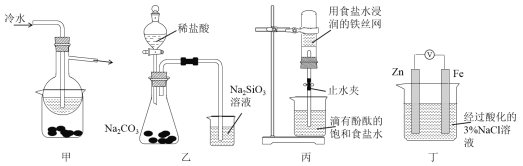
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学与生产生活密切相关,请写出下列反应
①实验室制氯气_________________(离子方程式)
②“腐蚀法”制作印刷电路板____________(化学方程式)并用双线桥表示该反应的电子转移数目和方向
(2)K2FeO4可用作水处理剂,它可由以下反应制得:
____Cl2 + ____ Fe(OH)3 + _____ OH- === ______ FeO4 2-+ _____ Cl- +____ H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法正确的是
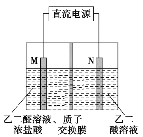
A. M极与直流电源的负极相连
B. 每得到lmol乙醛酸将有2molH+从右室迁移到左室
C. N电极上的电极反应式:HOOC-COOH-2eˉ+2H+ = HOOC-CHO+H2O
D. 每消耗0.1mol乙二醛在M电极放出2.24L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的核外电子排布图:![]() ,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
(3)基态溴原子的价层电子轨道排布图为_______,第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为_____,已知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。
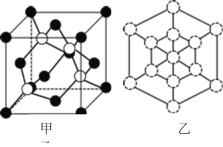
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置_____。
画出B原子的投影位置_____。
(5)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面休空隙数之比为__________,有__________%的正八面体空隙没有填充阳离子。
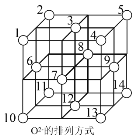
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com