
【题目】下列说法不正确的是
A.氨水使酚酞溶液变红是因为溶液中NH3H2O电离出OH-
B.KNO3溶于水电离出K+和NO3-
C.电离时生成的阳离子有H+的化合物不一定是酸
D.SO2溶于水能导电,所以SO2是电解质
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃玻璃棒、50 mL0.25 mol· L-1稀硫酸、50 mL 0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是:__________________、__________________。
(2)某同学用该装置做实验,因有些操作不规范,造成所测中和热的数值偏低,请分析可能的原因是_________________(用标号字母填写)。
A.测量稀硫酸温度后,温度计没用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C. 量取稀硫酸时仰视计数
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.大烧杯的盖板中间小孔太大了
(3)实验得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
假设0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都近似取1g/cm3,中和后所得溶液的比热容c =4.18 J/(g·℃)。则中和热ΔH =_____________ kJ/mol。
(4)如果用60mL0.25mol/L硫酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填:“增多”、“不变”、“减少”),所求中和热_________(填:“相等”、“不相等”)。
(5)若用KOH代替NaOH,对测定结果_______________(填:“有” 或 “无”)影响。![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图形象地表示了氯化钠的形成过程,下列相关叙述中,不正确的是( )
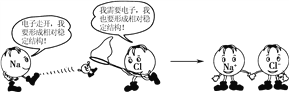
A. 钠原子易失去一个电子,氯原子易得到一个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D. 氯化钠是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:
TiO2 → TiCl4 ![]() Ti
Ti
已知:①C(s)+O2(g)===CO2(g) ΔH1 ②2CO(g)+O2(g)===2CO2(g) ΔH2
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为
A. ΔH3+2ΔH1+2ΔH2 B. ΔH3+2ΔH1+ΔH2
C. ΔH3+2ΔH1-ΔH2 D. ΔH3+2ΔH1-2ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 该电池若用隔膜可选用阴离子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-=Li1-xCoO2+xLi+
D. 对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL 1 mol L-1NaOH洛液稀释到100 mL,再取出5 mL稀释后的溶液,则这5 mL溶液中溶质的物质的量浓度是
A.0.05 mol L-1B.0.25 mol L-1C.0.1 mol L-1D.0.5 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将V1mL0.50mol/LH2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验装置和实验结果如下图所示(实验中始终保持V1 +V2=50mL)。回答下列问题:

(1)上图所示实验装置中有一个明显的错误________________。
(2)为了减少实验误差,实验过程中将NaOH溶液________________ (选填“一次”或“分多次”)倒入盛有稀硫酸的小烧杯中。溶液混合后,准确读取混合溶液的____________,记为终止温度。
(3)研究小组做该实验时环境温度________ 22°C(填“高于”、“ 低于”或“等于”),判断的依据是___________________。
(4)由题干及图形可知,V1:V2=_________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________ mol/L。
(5)若通过实验测定及有关计算知此反应共放出a kJ的热量.请写出此反应的热化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于影响化学反应速率的条件的说法正确的是( )
A.增大压强一定能加快化学反应速率
B.使用催化剂对化学反应速率没影响
C.增加反应物的量一定能加速化学反应速率
D.升高温度,一般能加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.04gNa2CO3、NaOH的固体混合物加水溶解,向该溶液中逐滴加入2mol·L﹣1的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中不正确的是( )
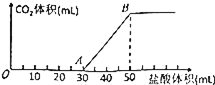
A.OA段发生反应的离子方程式为:H++OH﹣=H2O,CO32﹣+H+=HCO3﹣
B.B点溶液中的溶质为NaCl,其质量为5.85g
C.当加入50mL盐酸时,产生CO2的体积为896mL(标准状况)
D.混合物中NaOH的质量2.40g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com