
【题目】钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:
TiO2 → TiCl4 ![]() Ti
Ti
已知:①C(s)+O2(g)===CO2(g) ΔH1 ②2CO(g)+O2(g)===2CO2(g) ΔH2
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为
A. ΔH3+2ΔH1+2ΔH2 B. ΔH3+2ΔH1+ΔH2
C. ΔH3+2ΔH1-ΔH2 D. ΔH3+2ΔH1-2ΔH2
科目:高中化学 来源: 题型:
【题目】在一密闭恒容容器中,加入1molN2和3molH2发生反应:N2(g)+3H2(g)2NH3(g),下列叙述中能说明该反应达到平衡状态的是( )
A.![]() B.混合气体的密度保持不变
B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变D.![]() :
:![]() :
:![]() :3:2
:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表截取的短周期的一部分,即四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是 ( )
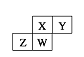
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物肯定为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 用醋酸检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3-
C. 用氢氧化钠溶液除去镁粉中的铝:2Al+2OH-+2H2O===2AlO![]() +3H2↑
+3H2↑
D. Na2S溶液使酚酞试液变红:S2-+2H2O![]() 2OH-+H2S
2OH-+H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J | ||||
R |
(1)M的离子结构示意图为__________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其分子式为______________。
(3)M和T形成的化合物在潮湿的空气中冒白烟,反应的化学方程式为___________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为__________________________________________________________。
②L的另一种氢化物乙通常用作火箭的燃料,其组成原子数之比为1∶2,则乙的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中说明NH3既有还原性,又有碱性的是( )
A. 4NH3+5O2![]() 4NO+6H2O B. NH3+HNO3=NH4NO3
4NO+6H2O B. NH3+HNO3=NH4NO3
C. 8NH3+3Cl2=N2+6NH4Cl D. 2NH3+3CuO![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氨水使酚酞溶液变红是因为溶液中NH3H2O电离出OH-
B.KNO3溶于水电离出K+和NO3-
C.电离时生成的阳离子有H+的化合物不一定是酸
D.SO2溶于水能导电,所以SO2是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。

(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的核外电子排布图:![]() ,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
(3)基态溴原子的价层电子轨道排布图为_______,第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为_____,已知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。
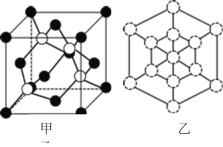
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置_____。
画出B原子的投影位置_____。
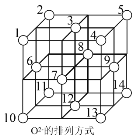
(5)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面休空隙数之比为__________,有__________%的正八面体空隙没有填充阳离子。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com