
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J | ||||
R |
(1)M的离子结构示意图为__________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其分子式为______________。
(3)M和T形成的化合物在潮湿的空气中冒白烟,反应的化学方程式为___________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为__________________________________________________________。
②L的另一种氢化物乙通常用作火箭的燃料,其组成原子数之比为1∶2,则乙的化学式为_____。
【答案】![]() ⅦA C2H4 AlCl3+3H2O===Al(OH)3+3HCl↑ 2NH3·H2O+3H2O2===N2↑+8H2O(或2NH3+3H2O2===N2↑+6H2O) N2H4
ⅦA C2H4 AlCl3+3H2O===Al(OH)3+3HCl↑ 2NH3·H2O+3H2O2===N2↑+8H2O(或2NH3+3H2O2===N2↑+6H2O) N2H4
【解析】
J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可以知道J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,故M为Al元素,而T是原子序数最大的元素,且为短周期主族元素,故T为Cl元素,由(4)题中L的最简单气态氢化物甲的水溶液显碱性,说明L为N元素。据此解答。
根据以上分析可知J、L、M、R、T分别是C、N、Al、S、Cl。则
(1)M的离子为Al3+,结构示意图为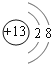 ;T为Cl元素,在周期表中位于第ⅦA族;
;T为Cl元素,在周期表中位于第ⅦA族;
(2)J和氢组成的化合物分子有6个原子,该化合物为C2H4;
(3)M和T形成的化台物为AlCl3,易水解,水解生成的HCl易结合空气中的水蒸气而形成酸雾,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑;
(4)①甲的水溶液为氨水,与H2O2反应生成的产物不污染环境,则生成N2和H2O,反应的化学方程式为2NH3·H2O+3H2O2=N2↑+8H2O;
②L的另一种氢化物乙通常用作火箭的燃料,其组成原子数之比为1∶2,则乙的化学式为N2H4。


科目:高中化学 来源: 题型:
【题目】下列各种说法中错误的是:
①化学反应除了生成新物质外,还伴随着能量的变化;②同温同压下,H2 (g)+Cl2 (g)==2HCl(g)在光照和点燃条件下的反应热ΔH不同;③为防治酸雨、降低工业废气,常用生石灰进行“钙基固硫”:CaO+SO2= CaSO3、2CaSO3+O2![]() 2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq)
2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
A. ①③④ B. ②⑥ C. ①④⑤ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol·L-1的 NH4HCO3溶液中逐渐加入0.1mol·L-1NaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量与起始物质的量比值)。根据图像,下列说法不正确的是
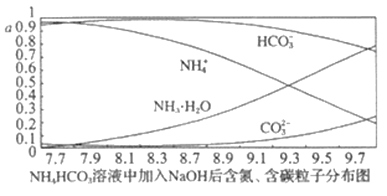
A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-=HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3·H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH===(NH4)2CO3+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图形象地表示了氯化钠的形成过程,下列相关叙述中,不正确的是( )
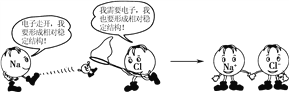
A. 钠原子易失去一个电子,氯原子易得到一个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D. 氯化钠是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是

A. 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B. 己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D. 在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:
TiO2 → TiCl4 ![]() Ti
Ti
已知:①C(s)+O2(g)===CO2(g) ΔH1 ②2CO(g)+O2(g)===2CO2(g) ΔH2
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为
A. ΔH3+2ΔH1+2ΔH2 B. ΔH3+2ΔH1+ΔH2
C. ΔH3+2ΔH1-ΔH2 D. ΔH3+2ΔH1-2ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 该电池若用隔膜可选用阴离子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-=Li1-xCoO2+xLi+
D. 对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将V1mL0.50mol/LH2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验装置和实验结果如下图所示(实验中始终保持V1 +V2=50mL)。回答下列问题:

(1)上图所示实验装置中有一个明显的错误________________。
(2)为了减少实验误差,实验过程中将NaOH溶液________________ (选填“一次”或“分多次”)倒入盛有稀硫酸的小烧杯中。溶液混合后,准确读取混合溶液的____________,记为终止温度。
(3)研究小组做该实验时环境温度________ 22°C(填“高于”、“ 低于”或“等于”),判断的依据是___________________。
(4)由题干及图形可知,V1:V2=_________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________ mol/L。
(5)若通过实验测定及有关计算知此反应共放出a kJ的热量.请写出此反应的热化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为__________________。
(2)ZX3分子的空间构型为__________________, ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_______(填化学式),原因是_____________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为:______________________________________________。
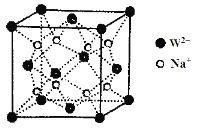
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________(填化学式)。Na+的配位数为________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com