
【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为__________________。
(2)ZX3分子的空间构型为__________________, ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_______(填化学式),原因是_____________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为:______________________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________(填化学式)。Na+的配位数为________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。
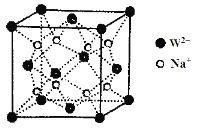
【答案】1s22s22p63s23p63d10 三角锥形 平面三角形 SiO2 SiO2为原子晶体,CO2为分子晶体 2Cu + 8NH3 + O2 + 2H2O == 2[Cu(NH3)4]2+ + 4OH Na2O 4 立方体
【解析】
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,则X为H元素;Y有三个能级,且每个能级上的电子数相等,核外电子排布为1s22s22p2,故Y为C元素;R与Y同一主族,结合原子序数可以知道,R为Si元素;W与Z同周期,第一电离能比Z的低,故W为O元素;而Z原子单电子数在同周期元素中最多,则外围电子排布为ns2np3,原子序数小于O元素,故Z为N元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,不可能为短周期元素,原子序数小于30,故核外电子排布为1s22s22p63s23p63d104s1,则Q为Cu元素.
(1)Cu+核外电子排布式为:1s22s22p63s23p63d10;
(2)ZX3为NH3,空间构型为三角锥形;ZW3-离子为NO3-,NO3-离子中N原子孤电子对数为(5+1-2×3)/2=0,价层电子对数为3+0=3,故其立体构型是平面三角形;
(3)Y、R的最高价氧化物分别为二氧化碳、二氧化硅,二氧化硅为原子晶体,二氧化碳为分子晶体,故沸点较高的是SiO2;
(4)将Cu单质的粉末加入到NH3的浓溶液中,并通入O2,充分反应后溶液呈深蓝色,反应生成[Cu(NH3)4]2+,该反应的离子方程式为: 2Cu + 8NH3 + O2 + 2H2O == 2[Cu(NH3)4]2+ + 4OH;
(5)晶胞中Na+离子数目为8,O2-离子数目为8×1/8+6×1/2=4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可以知道,每个Na+离子周围有4个O2-离子,Na+离子配位数为4,距一个阴离子周围最近的所有阳离子有8个,8个钠离子构成的几何体为立方体。


科目:高中化学 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J | ||||
R |
(1)M的离子结构示意图为__________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其分子式为______________。
(3)M和T形成的化合物在潮湿的空气中冒白烟,反应的化学方程式为___________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为__________________________________________________________。
②L的另一种氢化物乙通常用作火箭的燃料,其组成原子数之比为1∶2,则乙的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
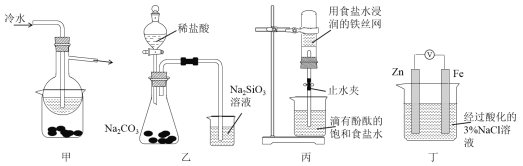
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法正确的是
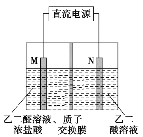
A. M极与直流电源的负极相连
B. 每得到lmol乙醛酸将有2molH+从右室迁移到左室
C. N电极上的电极反应式:HOOC-COOH-2eˉ+2H+ = HOOC-CHO+H2O
D. 每消耗0.1mol乙二醛在M电极放出2.24L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。
Ⅰ.实验室制备NaN3
(1)实验原理:
①把氨气通入熔融金属钠反应制得氨基钠(NaNH2),该反应的化学方程式为____________。
②将生成的NaNH2与N2O在210℃-220℃下反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______。
(2)实验装置(图1)、步骤如下,回答下列问题:
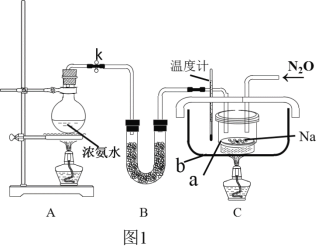
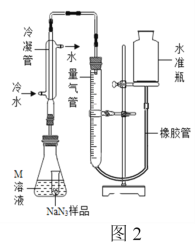
已知:i)NaN3是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
ii)NaNH2的熔点为210℃,沸点为400℃,在水溶液中易水解。
①组装仪器检查装置气密性后,装入药品。装置B中盛放的药品是_______________。
②实验过程应先点燃___(填“A”或“C”)处的酒精灯,理由是_______________________。
③让氨气和熔化的钠充分反应后,停止加热A并关闭止水夹k。向装置C中b容器内充入加热介质植物油并加热到210℃-220℃,然后按图通入N2O;
④装置C反应完全结束后,冷却,取出a中的混合物进行以下操作,得到NaN3固体:

操作II的目的是____________;
操作IV中选用的洗涤试剂最好的是_____。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
(3)图中仪器a用不锈钢材质的而不用玻璃的,其主要原因是____________________。
II.产品NaN3纯度测定
精确称量0.150 g NaN3样品,设计如图2所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度。
已知2 NaN3→ 3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)使用冷水冷凝的目的是______。对量气管读数时,反应前后都需要进行的操作是______。
(5)常温下测得量气管读数为60.0 mL(N2的密度为1.40 g/L)计算NaN3样品的纯度为______。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的核外电子排布图:![]() ,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
(3)基态溴原子的价层电子轨道排布图为_______,第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为_____,已知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。
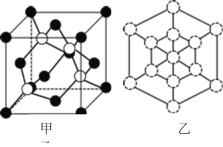
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置_____。
画出B原子的投影位置_____。
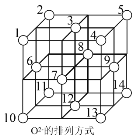
(5)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面休空隙数之比为__________,有__________%的正八面体空隙没有填充阳离子。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池总反应为Fe+2Fe3+=3Fe2+,下列与此电,池总反应不符的原电池是( )
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片锌片、Fe2(SO4)3溶液组成的原电池
D.银片、铁片、Fe(NO3)3溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代社会环境变化快、生活节奏快,很多人心理压力过大,紧张焦虑,导致抑郁患者量增加。某研究小组按下列路线合成抗抑郁药物吗氯贝胺:
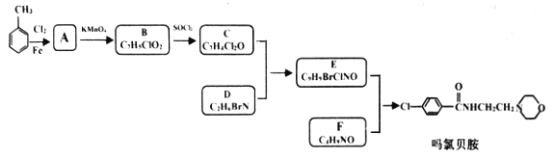
已知: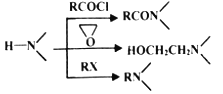
请回答:
(1)下列说法正确的是___________。
A.化合物A分子中有两种氢原子 B.合成路线所涉反应均为取代反应
C.化合物D具有碱性 D.吗氯贝胺能发生水解反应
(2)化合物F的结构简式是______________________。
(3)写出C+D→E的化学方程式____________________________________________。
(4)为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请设计以环氧乙烷(![]() )为原料合成X的合成路线_________________________________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线_________________________________(用流程图表示,无机试剂任选)。
(5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同分异构体的结构简式为______________________(任写一种)。
①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com