
【题目】(1)化学与生产生活密切相关,请写出下列反应
①实验室制氯气_________________(离子方程式)
②“腐蚀法”制作印刷电路板____________(化学方程式)并用双线桥表示该反应的电子转移数目和方向
(2)K2FeO4可用作水处理剂,它可由以下反应制得:
____Cl2 + ____ Fe(OH)3 + _____ OH- === ______ FeO4 2-+ _____ Cl- +____ H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为_____
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2 ↑+2H2O
Mn2++Cl2 ↑+2H2O 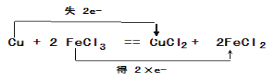 3 2 10 2 6 8 3NA 或1.806×1024
3 2 10 2 6 8 3NA 或1.806×1024
【解析】
(1)①实验室通过二氧化锰和浓盐酸反应制取氯气,方程式为MnO2+4H++2Cl-![]() Mn2++Cl2 ↑+2H2O;
Mn2++Cl2 ↑+2H2O;
②“腐蚀法”制作印刷电路板是用氯化铁刻蚀铜板,化学方程式为Cu+2FeCl3=CuCl2+2FeCl2,反应氯化铁是氧化剂在反应中得到电子,铜单质是还原剂在反应中失去电子,用双线桥表示该反应的电子转移数目和方向为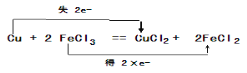 ;
;
(2)配平氧化还原反应,先通过得失电子数守恒对氧化还原部分进行配平,然后通过电荷守恒、原子守恒对剩余部分进行配平, 配平后的方程式为3Cl2 +2Fe(OH)3+10OH- =2FeO4 2-+6Cl-+8H2O,当1mol K2FeO4生成时,转移的电子数目为1.806×1024。


科目:高中化学 来源: 题型:
【题目】将10 mL 1 mol L-1NaOH洛液稀释到100 mL,再取出5 mL稀释后的溶液,则这5 mL溶液中溶质的物质的量浓度是
A.0.05 mol L-1B.0.25 mol L-1C.0.1 mol L-1D.0.5 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是
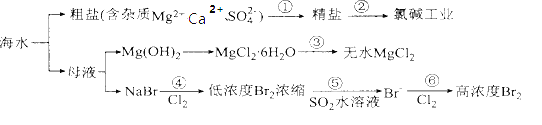
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.
A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸
B.过程②通过氧化还原反应可产生1种单质
C.在过程③中将MgCl26H2O直接灼烧得到MgCl2
D.在过程④、⑥反应中每氧化0.2molBr-需消耗标准状况下2.24LCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于影响化学反应速率的条件的说法正确的是( )
A.增大压强一定能加快化学反应速率
B.使用催化剂对化学反应速率没影响
C.增加反应物的量一定能加速化学反应速率
D.升高温度,一般能加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2X溶液中滴加0.2mol/L NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法不正确的是
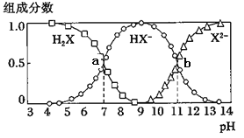
A. 水的电离程度: b点大于点a
B. 将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C. 常温下HY的K=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y—=HY+HX—
D. 常温下,反应X2— + H2O ![]() HX— + OH—的平衡常数对数值1gK= -3
HX— + OH—的平衡常数对数值1gK= -3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.小苏打溶液中加入烧碱溶液:![]()
B.氯化铝溶液中加入过量氨水:![]()
C.向氯化亚铁溶液中加入氯水:![]()
D.氢氧化钡溶液与稀硫酸混合Ba2++OH-+SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com