
【题目】下列离子方程式中正确的是( )
A.小苏打溶液中加入烧碱溶液:![]()
B.氯化铝溶液中加入过量氨水:![]()
C.向氯化亚铁溶液中加入氯水:![]()
D.氢氧化钡溶液与稀硫酸混合Ba2++OH-+SO42-+H++OH-=BaSO4↓+H2O
科目:高中化学 来源: 题型:
【题目】(1)化学与生产生活密切相关,请写出下列反应
①实验室制氯气_________________(离子方程式)
②“腐蚀法”制作印刷电路板____________(化学方程式)并用双线桥表示该反应的电子转移数目和方向
(2)K2FeO4可用作水处理剂,它可由以下反应制得:
____Cl2 + ____ Fe(OH)3 + _____ OH- === ______ FeO4 2-+ _____ Cl- +____ H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线及部分反应机理如图所示:
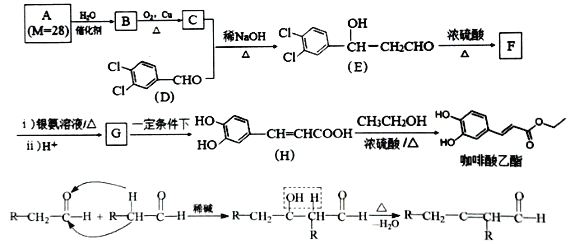
回答下列问题:
(1)B中官能团的名称是______________________。
(2)E→F反应类型为______________________。
(3)D分子中位于同一平面上的原子最多有___________个。
(4)F的结构简式为______________________。
(5)H→咖啡酸乙酯的化学方程式为____________________________________________。
(6)芳香族化合物M是H的同分异构体,1molM与足量碳酸氢钠溶液反应生成2molCO2,M的三取代基结构有___________种;M的两取代基同分异构体核磁共振氢谱为5组峰,峰面积比为1:2:2:2:1,其结构简式为______________________。
(7)设计以甲醛、C为原料合成C5H12O4(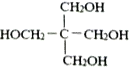 )的路线(无机试剂任选)。___________________________。
)的路线(无机试剂任选)。___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.3 g钠投入38.8 g水中,发生化学反应。假设水蒸发损失1 g,所得溶液中溶质的质量分数为( )
A. 4.6% B. 7.7% C. 10.0% D. 8.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. H2(g)转化为氢原子是一个放热过程
B. 1molH2和1molCl2的总能量比2molHCl的总能量低
C. 1 个 HCl(g)分子中的化学键断裂时需要吸收431.8 kJ能量
D. 2HCl(g)= H2(g)+Cl2(g)的反应热ΔH=+184.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)![]() CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是
CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是

A. 平衡常数K(300 ℃)<K(500 ℃)
B. 在其他条件不变时,压缩处于E点的体系体积,氢气浓度增大
C. 300 ℃,当容器内气体密度不变时说明反应已经达到平衡
D. 500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)=![]() mol·L1·min1
mol·L1·min1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com