
【题目】下列金属中,常温下在浓硫酸中发生钝化反应的是
A.MgB.AlC.CuD.Ag
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】将10 mL 1 mol L-1NaOH洛液稀释到100 mL,再取出5 mL稀释后的溶液,则这5 mL溶液中溶质的物质的量浓度是
A.0.05 mol L-1B.0.25 mol L-1C.0.1 mol L-1D.0.5 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2X溶液中滴加0.2mol/L NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法不正确的是
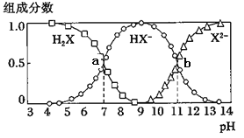
A. 水的电离程度: b点大于点a
B. 将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C. 常温下HY的K=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y—=HY+HX—
D. 常温下,反应X2— + H2O ![]() HX— + OH—的平衡常数对数值1gK= -3
HX— + OH—的平衡常数对数值1gK= -3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.04gNa2CO3、NaOH的固体混合物加水溶解,向该溶液中逐滴加入2mol·L﹣1的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中不正确的是( )
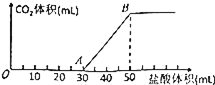
A.OA段发生反应的离子方程式为:H++OH﹣=H2O,CO32﹣+H+=HCO3﹣
B.B点溶液中的溶质为NaCl,其质量为5.85g
C.当加入50mL盐酸时,产生CO2的体积为896mL(标准状况)
D.混合物中NaOH的质量2.40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
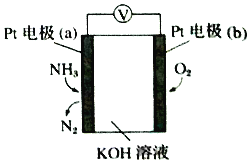
A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 正极的电极反应式为O2+4e-+4H+=2H2O
D. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂,某化学兴趣小组利用氮氧化物与过氧化钠反应制备亚硝酸钠并进行一系列实验探究。
查阅资料:
①SO2+Na2O2=Na2SO4,NO2和NO能与Na2O2发生类似反应。
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且有无色气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
I.制备亚硝酸钠

(1)装置A用恒压滴液漏斗,相比普通分液漏斗,显著的优点是______________________。
(2)上述装置按气流方向连接的顺序为:A→___________→___________→___________→C(填仪器编号,且都是左进右出)。
(3)如果没有B装置,D中发生反应的化学方程式为_________________________________。(有几个就写几个,填化学方程式)。
(4)C装置的作用是_________________________________(用离子方程式表示)。
Ⅱ.测定产品纯度,实验步骤:
①准确称量5.000g产品配成250mL溶液。
②从步骤①配制的溶液中移取25.00mL注入锥形瓶中。
③用0.1000mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为20.00mL
(5)达到滴定终点的现象是____________________________________________。产品中NaNO2的纯度为___________%。
(6)设计实验证明HNO2的酸性比碳酸强_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.小苏打溶液中加入烧碱溶液:![]()
B.氯化铝溶液中加入过量氨水:![]()
C.向氯化亚铁溶液中加入氯水:![]()
D.氢氧化钡溶液与稀硫酸混合Ba2++OH-+SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是_____________________________________________,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是______________________________。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中______。
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:

丙组同学的实验装置中,依次连接的合理顺序为A→ _______;其中仪器F的名称___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com