
【题目】下列类型的反应,一定属于氧化还原反应的是
A.复分解反应B.分解反应
C.化合反应D.置换反应
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7的水溶液中存在如下平衡:
Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________
2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________
已知:(在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入氢氧化钠,溶液呈___色;向已加入氢氧化钠的溶液中,再加入过量硫酸,溶液呈___________色。
(2)在KMnO4与H2C2O4反应中,可通过测定_________________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:__________________;此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用
B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
①该实验进行的目的是_____________
②表中Vx=_______mL,比较t1、t2、t3大小____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO3ˉ和Mn2+。
I.用下图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2=2NaNO2)。

(1)B、D的仪器名称是________,D的作用是________。
(2)通NO前,需先通一段时间N2,目的是________,
(3)E中主要反应的离子方程式为________,
(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2________g。
Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na2O2反应的产物,提出如下假设:
假设i.NO2氧化Na2O2;假设ii.Na2O2氧化NO2。
甲同学设计如图所示实验装置:

请回答下列问题:
(5)单向阀在实现气体单向流通的同时,还有一个作用是___________。
(6)待试管G中收集满气体,向试管G中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,甲同学据此认为假设i正确。乙同学认为该装置不能达到实验目的,为达到实验目的,应在F、G之间增加一个M装置,M中应盛装__________(可供选择的试剂:碱石灰,浓硫酸饱和氯化钠溶液);乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得到结论:假设ⅱ正确。
请做出正确判断,写出NO2和Na2O2反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表截取的短周期的一部分,即四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是 ( )
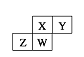
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物肯定为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
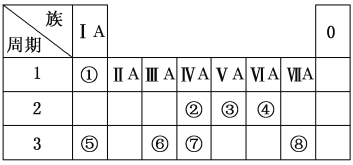
(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)_________________。
(2)⑤、⑧元素的化合物的用电子式表示形成过程:___________________________。
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)_____________。
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
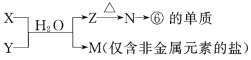
X溶液与Y溶液反应的离子方程式为___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 用醋酸检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3-
C. 用氢氧化钠溶液除去镁粉中的铝:2Al+2OH-+2H2O===2AlO![]() +3H2↑
+3H2↑
D. Na2S溶液使酚酞试液变红:S2-+2H2O![]() 2OH-+H2S
2OH-+H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中说明NH3既有还原性,又有碱性的是( )
A. 4NH3+5O2![]() 4NO+6H2O B. NH3+HNO3=NH4NO3
4NO+6H2O B. NH3+HNO3=NH4NO3
C. 8NH3+3Cl2=N2+6NH4Cl D. 2NH3+3CuO![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学与生产生活密切相关,请写出下列反应
①实验室制氯气_________________(离子方程式)
②“腐蚀法”制作印刷电路板____________(化学方程式)并用双线桥表示该反应的电子转移数目和方向
(2)K2FeO4可用作水处理剂,它可由以下反应制得:
____Cl2 + ____ Fe(OH)3 + _____ OH- === ______ FeO4 2-+ _____ Cl- +____ H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com