
| A. | 奥运场馆“鸟巢”使用的代号为Q460的特殊钢是合金 | |
| B. | 乙醇是可再生的燃料,车用乙醇汽油值得提倡 | |
| C. | 复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能 | |
| D. | 含植物营养元素氮、磷的生活污水有利于水生植物成长,可以净化天然水体 |
分析 A.Q460特殊钢的是含其它元素的铁合金;
B.乙醇可再生,为清洁燃料;
C.复合材料的主要优点有:强度高、耐高温、耐腐蚀性,同时又具有质量轻的优点;
D.氮、磷的生活污水可导致水体的富营养化.
解答 解:A.Q460特殊钢含有铌(Nb)、钒(V)、钛(Ti)等元素,所以属于合金,故A正确;
B.乙醇可再生,可充分燃烧,为清洁燃料,故B正确;
C.复合材料具有多种材料的优良性能,强度高、质量轻、耐高温、耐腐蚀,故C正确;
D.氮、磷的生活污水可导致水体的富营养化,导致水华、赤潮等污染,故D错误.
故选D.
点评 本题考查较为综合,为高考常见题型,侧重化学与生活、生产以及环境保护等知识,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
 一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )| A. | b极为电池的负极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 当1 mol乙醇被氧化转移12NA个电子 | |
| D. | 电池负极的电极反应为4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 分解反应都是吸热反应,化合反应都是放热反应 | |
| C. | 若反应放热,则反应物的总能量大于生成物的总能量 | |
| D. | 利用化学反应可以合成自然界中不存在的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 | |
| B. | 由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 | |
| C. | 稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素 | |
| D. | 金属钠通常被保存在煤油或石蜡油中,以隔绝空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
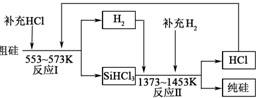 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.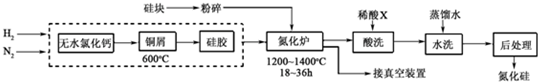
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 35mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2g Na2CO3 | 20.0 | 25.1 |
| A. | Na2CO3溶液与盐酸的反应是吸热反应 | |
| B. | NaHCO3溶液与盐酸的反应是放热反应 | |
| C. | 20.0℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1℃ | |
| D. | 20.0℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态铜原子的价电子排布图: | |
| B. | CO2分子立体结构模型: | |
| C. | 三氟化硼的电子式: | |
| D. | 35Br基态原子的电子排布式可简写为[Ar]4s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com