
| A. | 基态铜原子的价电子排布图: | |
| B. | CO2分子立体结构模型: | |
| C. | 三氟化硼的电子式: | |
| D. | 35Br基态原子的电子排布式可简写为[Ar]4s24p5 |
分析 A.u的原子序数为29,价电子排布为3d104s1;
B.比例模型中用不同体积的小球表示不同原子的大小,碳的原子半径比氧的大;
C.三氟化硼为共价化合物,B原子与F原子形成3个共用电子对;
D.[Ar]的核外电子排布式为:1s22s22p63s23p6,而溴的前3层核外电子排布式为:1s22s22p63s23p63d10.
解答 解:A.Cu的原子序数为29,价电子排布为3d104s1,基态铜原子的价电子排布图为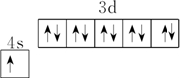 ,故A错误;
,故A错误;
B.碳和氧位于同一周期,从左到右原子半径逐渐减小,故碳的原子半径较大,CO2分子比例模型: ,故B错误;
,故B错误;
C.三氟化硼中F、B原子形成3对共用电子对,其电子式为 ,故C正确;
,故C正确;
D.35Br元素为35号元素,原子核外有35个电子,核外电子排布式为:1s22s22p63s23p63d104s24p5,所以不能用[Ar]4s24p5表示,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及比例模型、电子式、电子排布式等知识,明确常见化学用语的书写原则为就关键,试题培养了学生的规范答题能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C═CH2+H2$\stackrel{催化剂}{→}$H3C-CH3 | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu/△}{→}$2CH3CHO+2H2O | |
| C. | 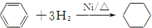 | |
| D. | 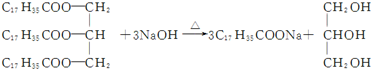 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 奥运场馆“鸟巢”使用的代号为Q460的特殊钢是合金 | |
| B. | 乙醇是可再生的燃料,车用乙醇汽油值得提倡 | |
| C. | 复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能 | |
| D. | 含植物营养元素氮、磷的生活污水有利于水生植物成长,可以净化天然水体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
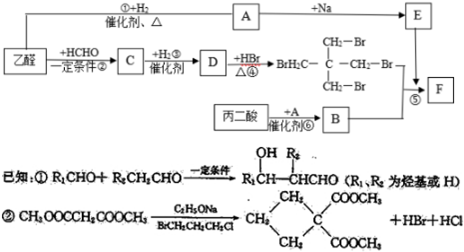
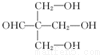 .
. .
.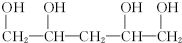 .
.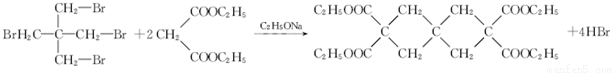 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知大多数含氧酸可用通式XOm(OH)n来表示,H2SeO3、HMnO4、H3BO3、H3PO4 四种酸中酸性最强的是H2SeO3 | |
| B. | HF的沸点比H2O低是因水中氢键的键能比氟化氢中氢键能大 | |
| C. | 向加入过量氨水的硫酸铜溶液中加入乙醇,将析出深蓝色晶体来,是因为乙醇分子极性比水小 | |
| D. | H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
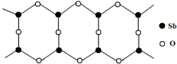

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com