
����Ŀ����ѧ��Ӧ�ǻ�ѧʵ������ı��ʣ����������ش��������⣺
��1����BaCl2��Һ��ͨ��SO2���壬δ���������ɣ�����ͨ���������е���һ�����ʣ���ͨ��SO2�ܿ�����������___(�����)��
��NO2 ��NH3 ��HCl ��FeCl3��Һ ��CO2
��2��A��B��C��D��E��������(������)������ͬһ��Ԫ�أ�����֮������ͼ��ʾ��ת����ϵ��
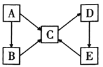
��AΪ�������ʣ�B��C���������࣬B��Һ�ʻ�ɫ�������軯����Һ��Ϻ��Ժ�ɫ��D��һ�ְ�ɫ������E��һ�ֲ����ԼB��Һ�����Ե�ԭ����___(�����ӷ���ʽ��ʾ)��ѡ����������E��Ӧʵ��E��C��ת�����÷�Ӧ�����ӷ���ʽΪ___��
��3����ͨ�������£�δ����ĥ��þ�ۺ�δ�����õ�þ������ˮ����Ӧ����Ϊ������һ�㱣��Ĥ��ȥ���������Ĥ��þ����ˮ�ͻᷢ�����Եķ�Ӧ�������д���ϸ������ݲ����������������£���Ӧ���ɵ�������ˮ��������þ�������ڱ����γ����ܱ�Ĥ�������Ӻ�Ӧ�ܿ�ֹͣ������Ӧ���Һ���ȣ�þ��ˮ�������ֻ����½��У�����ÿ��ܵ�ԭ���ǣ�___����ʱ�μӷ�̪��Һ��___(��ᡱ���ᡱ)������Һ��������
��ȡһ�β�ȥ��������Ĥ��þ������������״������ʢ��ʳ��ˮ���Թ��У����Թܵ�����ʢ��ʳ��ˮ���ձ��У�����Ѹ�ٹ۲쵽þ�������ϵظ�ˮ��Ӧ������ÿ��ܵ�ԭ����___��
��ȥ��������Ĥ�Ľ���Mg������NaHCO3��Һ����������������Һ���а�ɫ���������ɡ���������þֱ����ˮ��Ӧ��ת��ΪH2��Mg(OH)2���ܽ���ˮ�е�����Mg(OH)2�������ɵ�OH������Һ�е�HCO3����Ӧ����CO32������ʹ��Ӧ���ɵ�Mg(OH)2�����ܽ⡣��Һ��Mg2����OH����CO32�������������ɫ������Mg2(OH)2CO3�������������Ϣд��Mg��NaHCO3��Һ���ܷ�Ӧʽ��___(�����ӷ���ʽ��ʾ)��
���𰸡��٢ڢ� Fe3++3H2O![]() Fe(OH)3+3H+ 2 Fe(OH)3+6 H++2I-=2Fe2++I2+6H2O ���ȴٽ���ˮ�ĵ���ʹH+Ũ����������������Mg(OH)2���ܽ�� �� Cl-�ٽ��˷�Ӧ�ķ��� 2Mg+2HCO3-+2H2O=2H2��+CO32-+Mg2(OH)2CO3
Fe(OH)3+3H+ 2 Fe(OH)3+6 H++2I-=2Fe2++I2+6H2O ���ȴٽ���ˮ�ĵ���ʹH+Ũ����������������Mg(OH)2���ܽ�� �� Cl-�ٽ��˷�Ӧ�ķ��� 2Mg+2HCO3-+2H2O=2H2��+CO32-+Mg2(OH)2CO3
��������
(1)BaCl2��Һ��ͨ��SO2���壬δ���������ɵ�ԭ����BaSO3���������ᣬ������������˼·���ٽ�������Ϊ������BaCl2��Ӧ���ڽ���ת��ΪSO32-��BaCl2��Ӧ�������Ϸ������
(2) Fe(OH)3���������ʱ������Fe3+��I-�ᷢ��������ԭ��Ӧ��
(3)���谭þ��ˮ��Ӧ���е���Ҫ�����dz����ڱ�������ܱ�ĤMg(OH)2�����Ⱥ�ٽ���ˮ��Ҳ��ʹH+Ũ�������ӿ췴Ӧ���ʡ�ͬʱ���»�ʹ�����ܽ������ʹ֮�ܽ⣬��Ӧ���Լ�����ȥ��Mg(OH)2������ǿ�������������Һ��pHԼΪ11���ң�����ʹ��̪��졣
����ʳ��ˮ�з�Ӧ���ʼӿ���ܵ�ԭ��Cl-�ٽ��˷�Ӧ�ķ����ȣ�
��Mg��NaHCO3��Һ��Ӧ������������ʽ̼��þ��̼���ơ�
��1����NO2���������ԣ�����Һ�н�SO2����ΪSO42�����ӣ����ɳ���BaSO4���ʢ�ѡ��
��NH3��ˮ��Ӧ����NH3H2O��NH3H2O���������Ӧ����������泥���Һ�����ɴ�����SO32�����ӣ����ɳ���BaSO3���ʢ�ѡ��
��HCl��SO2������BaCl2��Ӧ��ͨ��SO2��HCl���������ɳ������ʢ۲�ѡ��
��FeCl3��Һ���������ԣ���SO2����ΪSO42�����ӣ����ɳ���BaSO4���ʢ�ѡ��
��SO2��CO2������BaCl2��Ӧ����������Ӧ���ᶼ����������ͨ��SO2��CO2���������ɳ������ʢݲ�ѡ��
��ѡ�٢ڢܣ�
��2��B��Һ�ʻ�ɫ�������軯����Һ��Ϻ��Ժ�ɫ��˵��B�к���Fe3+��AΪFe�����E��һ�ֲ����Լ��֪C�к�Fe2+��DΪFe(OH)2��EΪFe(OH)3��B�к���Fe3+��B��Һ�����Ե�ԭ����Fe3++3H2O![]() Fe(OH)3+3H+��E��C�����ӷ���ʽΪ2Fe(OH)3��2I����6H����2Fe2����I2��6H2O��
Fe(OH)3+3H+��E��C�����ӷ���ʽΪ2Fe(OH)3��2I����6H����2Fe2����I2��6H2O��
(3)���谭þ��ˮ��Ӧ���е���Ҫ�����dz����ڱ�������ܱ�ĤMg(OH)2�����Ⱥ�ٽ���ˮ�ĵ��룬ʹH+Ũ�����ӿ��˷�Ӧ���ʡ�ͬʱ���»�ʹ�����ܽ������ʹ֮�ܽ⣬��Ӧ���Լ�����ȥ��Mg(OH)2������ǿ�������������Һ��pHԼΪ11���ң�����ʹ��̪��졣
����ʳ��ˮ�з�Ӧ���ʼӿ���ܵ�ԭ��Cl-�ٽ��˷�Ӧ�ķ����ȣ�
��Mg��NaHCO3��Һ��Ӧ������������ʽ̼��þ��̼���ƣ���Ӧ�����ӷ���ʽΪ2Mg+2HCO3-+2H2O=2H2��+CO32-+Mg2(OH)2CO3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ����������ӣ�H+��Mg2+��Al3+��NH4+��Cl����AlO2-���������Һ����μ���NaOH��Һʱ���������������ʵ���(n)�����NaOH��Һ�����(V)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A. ԭ��Һ��һ�����е���������H+��Mg2+��Al3+��NH4+
B. ��Ӧ����γɵ���Һ�е����ʺ�AlCl3
C. ԭ��Һ��Al3+��NH�����ʵ���֮��Ϊ1��3
D. ԭ��Һ�к��е���������Cl����AlO2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ��Դӵ��ͭ������������ȡ�ܶ���Ҫ���ʣ��乤���������£�
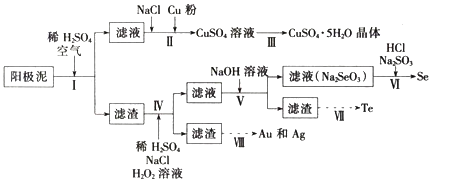
��֪�������������Ҫ��ѧ�ɷ֣������ʾ��
��Ҫ�ɷ� | Cu Ag Au Se Te |
�ٷֺ���/% | 23.4 12.1 0.9 6.7 3.1 |
���¶Ⱥ�����Ũ�ȶ��������и���ֽ����ʵ�Ӱ�죬�����ʾ��
�̶������¶� | �̶�H2SO4Ũ�� | |||
H2SO4Ũ�� / mol��L��1 | ������/% | �����¶�/�� | ������/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 ��0.2 0.83 8.93 | 30 | 87.1 4.58 ��0.2 0.08 6.83 | |
3 | 94.5 4.65 ��0.2 0.28 6.90 | 40 | 94.5 4.65 ��0.2 0.28 6.90 | |
2 | 78.1 2.65 ��0.2 0.05 2.85 | 50 | 96.1 5.90 ��0.2 0.64 8.73 |
(1)����I����ҪĿ��Ϊ����ͭ����������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________��������2���ݣ���֪����I���ʺϵ�����Ϊ______________��
(2)����II�У�����Cu�۵�Ŀ���dz�ȥ��Һ�к��ڵ����ӣ�����NaCl��Ŀ��Ϊ________��
(3)����III�IJ�������Ϊ___________��
(4)����IV�У���Ӧ�¶�Ϊ75��������H2O2��Һ����Ϊ______________���˹�����H2O2��Һ��������ҪԶԶ��������ֵ��ԭ��Ϊ_____________��
(5)����VI����������Ӧ�Ļ�ѧ����ʽΪ_______��
(6)����VII�У����Ի����µ��Na2TeO3��Һ�ɵ�Teʵ�֣������ĵ缫��ӦʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
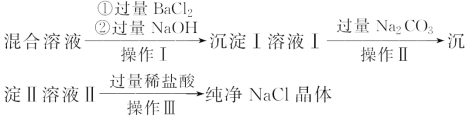
����Ŀ�����к�NaCl��MgCl2��Na2SO4�Ļ����Һ��ij��ȤС���ͬѧ����ȡ������NaCl���壬���������ʵ�飺
��ش��������⣺
(1)д��������ͳ������������ʵĻ�ѧʽ��������_________��������_______��
(2)���������У��������ϡ�����Ŀ����______________��
(3)����������ʹ�õIJ���������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ�̼�����ڵ��ӹ�ҵ��������Ҫ��Ӧ�ã�ʪ���������̿�(��Ҫ�ɷ�ΪMnO2����������Fe��Al��Mg������Ԫ��)�Ʊ��ߴ�̼���̵��������£����г��ӹ��̰������������Һ�м���һ�������Լ�X�����ڽ���Һ��pHΪ3.5��5.5�����ټ���һ���������̿��˫��ˮ�����ˣ��ۡ�����˵����ȷ����(��֪�����£�Kap[Mg(OH)2]��1.8��10��11��Kap[Al(OH)3]��3.0��10��34��Kap[Fe(OH)3]��4.0��10��38��)
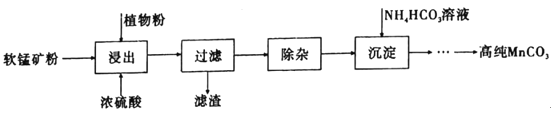
A.����ʱ����ֲ��۵���������Ϊ��ԭ��
B.���ӹ����е��ڽ���Һ��pHΪ3.5��5.5����ȫ��ȥFe��Al��Mg������
C.�Լ�X������MnO��MnO2��MnCO3������
D.Ϊ��߳���MnCO3��������ʿ��Գ��������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A�Ľṹ��ʽ����ͼ��
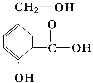
��1����д�������ʵĺ�������������______��______��______��
��2����д�����»�ѧ��Ӧ�ķ���ʽ��
��A��NaOH��Һ��Ӧ��__________
��A��NaHCO3��Һ��Ӧ��__________
��A��һ�������¸�Na��Ӧ��__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�������л���Ľṹ��ʽ������Υ��ϵͳ�����������Ծ�����
��1��3,5����������________________����ȷ���ƣ�________________
��2��3,3,4,4���ļ���2���һ�����________________����ȷ���ƣ�________________
��3��4,4,5,5���ļ���3����������________________����ȷ���ƣ�________________
��4��2,3,4,5���ļ���3���һ���5����������____________����ȷ���ƣ�______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�á�
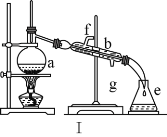
��1��д���������������ƣ�a��____��b��_____��c��____��
��2������ae�У�ʹ��ǰ�������Ƿ�©ˮ����____������ţ���
��3��������װ�â�������Ȼ�̼�;ƾ��Ļ����¶ȼ�ˮ�����λ����____��������ˮ�ɣ�����f������g������ͬ��____��ͨ�룬_____��������
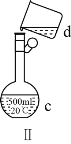
��4����������0.13mol��L1NaOH��Һ450mL��װ�â���ijͬѧת����Һ��ʾ��ͼ��
�ٸ��ݼ�����������ƽ��ȡNaOH��Һ������Ϊ_____g��Ϊ��ɴ���Һ����ʵ����Ҫ�IJ���������______��
��ͼ���еĴ�����_____��
������ʱ�������¼���������У����㡢�������ܽ⡢��ȴ��ת�ơ����ݡ�ҡ�ȡ�װƿ�������л�ȱ��һ����Ҫ������_____��
��ȡ����������ĸ�NaOH��Һʱ�������������в�����ȡ����Ķ��ٶ��仯����_____������ĸ����
A.��Һ��Na�����ʵ��� B.��Һ��Ũ��
C.NaOH���ܽ�� D.��Һ���ܶ�
����������������NaOH��ҺŨ��ƫ�ߵ���_____��
A.��¶�ڿ����г���NaOH��ʱ��̫��
B.��������������ϣ� NaOH���������Ͻ��г�����ʹ�����룩
C.������ƿת��Һ��ʱ������ƿ�ں�������ˮ
D.�ܽ��δ��ȴ�����¾�ת��������ƿ
E.ת��Һ��ʱ���������¶˷�������ƿ�̶������ϴ�
F.����ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι�����
G.����ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѹǿ�仯����ʹ���л�ѧ��Ӧ��ƽ�ⷢ���ƶ�����(����)
A. C(s)+CO2(g)![]() 2CO(g)B. 3H2(g)+N2(g)
2CO(g)B. 3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
C. 2SO2(g)+O2(g)![]() 2SO3(g)D. H2(g)+I2(g)
2SO3(g)D. H2(g)+I2(g)![]() 2HI(g)
2HI(g)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com