
����Ŀ��������̼�IJ����������������ʵ������������ŵ���Ҫ;��֮һ��
(1)������̼�ĵ���ʽΪ___________��
(2)�������ö�����̼�ķ�Ӧ��ԭ�������ʴ�100%����_____(�����)��
a��CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b��CO2��CH4![]() CH3COOH
CH3COOH
c��CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d��
(3)һ�����ڿ��������ö�����̼��ȡ�״����������£�

�ٷ�Ӧ(��)��CO2��H2Oת��Ϊ���᳣��;�������֣�����ͼ(a)�� (b)��

ͼ(a)��������Ҫת����ʽΪ____��ͼ(b)�з�����Ӧ�Ļ�ѧ����ʽΪ_____��
����5L�ĺ��º����ܱ������г���1moLCO��4molH2���������������Ӧ�����CO��CH3OH�����ʵ�����ʱ��仯����ͼ��ʾ��

ͼ�е�______min(������)��Ӧ�ﵽƽ�⣬CO��0��4min�ڵ�ƽ����Ӧ���ʱ���4��8min�ڵĿ죬��ԭ����______���ﵽƽ��ʱ������Ũ��Ϊ______��
(4)��֪����(������)1mol��ѧ������(��ų�)��������Ϊ���ܣ���ӦH2(g)+ I2(g)=2HI(g)��ؼ����������£�
��ѧ�� | H��I | H��H | I��I |
����/kJ��mol��1 | 298.7 | 436.0 | 152.7 |
��÷�Ӧ�ġ�HΪ_________kJ��mol-1��
(5)��������Ϊ���������ں��º����ܱ������г���һ������NO��NH3����һ�������·�����Ӧ��6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)��
5N2(g) +6H2O(g)��
����˵���÷�Ӧ�Ѵﵽƽ��״̬�ı�־��_________(������ѡ��)��
a����Ӧ����v( NH3) =v( N2)
b��������ѹǿ������ʱ��������仯
c��������N2�����ʵ�������������ʱ��������仯
d��������n(NO)��n(NH3)��n(N2)��n(H2O) = 6��4��5��6
��ij��ʵ���в��������NO��N2�����ʵ�����ʱ��仯����ͼ��ʾ��ͼ��v(��)��v(��)��ȵĵ�Ϊ______(ѡ����ĸ)��
���𰸡�![]() bd ����ת���ɻ�ѧ�� 2CO2+2H2O
bd ����ת���ɻ�ѧ�� 2CO2+2H2O![]() 2HCOOH+ O2 10 0��4 min��Ӧ��Ũ�ȴ� 0.5mol��L-1 -8.7 bc cd
2HCOOH+ O2 10 0��4 min��Ӧ��Ũ�ȴ� 0.5mol��L-1 -8.7 bc cd
��������
(1)̼����֮���γ�˫������ԭ�Ӻ�̼ԭ������㶼Ϊ8�����ӣ�������̼�ĵ���ʽΪ![]() �� �ʴ�Ϊ��
�� �ʴ�Ϊ��![]() ��
��
(2)a���и���Ʒˮ���ɣ�ԭ��������û�дﵽ100%����a����
b����ӦΪ���Ϸ�Ӧ����Ӧ��ȫ��ת��Ϊ�����û�������������ɣ���ԭ�������ʴ�100%����b��ȷ��
c���и�����ˮ���ɣ�ԭ��������û�дﵽ100%����C����
d���÷�ӦΪ�ۺϷ�Ӧ��ԭ�������ʴﵽ100%����d��ȷ��
���ö�����̼�ķ�Ӧ��b�ǻ��Ϸ�Ӧ��d�ǾۺϷ�Ӧԭ�������ʴ�100%���ʴ�Ϊ��bd��
(3)ͼ(a)���ڹ��������½�CO2��H2Oת��Ϊ���ᣬ������Ҫת����ʽΪ����ת���ɻ�ѧ�ܣ�ͼ(b)��CO2��H2O����HCOOH�� O2��������Ӧ��ͨ�������������������������ɼ��ᣬ������Ӧ�Ļ�ѧ����ʽΪ2CO2+2H2O![]() 2HCOOH+ O2���ʴ�Ϊ������ת���ɻ�ѧ�ܣ�2CO2+2H2O
2HCOOH+ O2���ʴ�Ϊ������ת���ɻ�ѧ�ܣ�2CO2+2H2O![]() 2HCOOH+ O2��
2HCOOH+ O2��
�ڷ�Ӧ�ﵽƽ��״̬���ʵ����ʵ������䣬ͼ����10minʱ��Ӧ�ﵽƽ��״̬����ʱCO���ʵ���0.25mol���仯��1.00mol-0.25mol=0.75mol���״�������0.75mol��CO��0��4min�ڵ�ƽ����Ӧ���ʱ���4��8min�ڵĿ죬��ԭ�������ŷ�Ӧ�Ľ���CO��Ũ�Ȳ��ϱ�С���������������ѹǿ���ϼ�С����
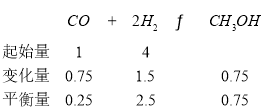
�ﵽƽ��ʱ������Ũ��=![]() =0.5mol��L��1��ƽ��ʱ������Ũ��Ϊ0.5mol��L-1���ʴ�Ϊ��10��0��4 min��Ӧ��Ũ�ȴ�0.5mol��L-1��
=0.5mol��L��1��ƽ��ʱ������Ũ��Ϊ0.5mol��L-1���ʴ�Ϊ��10��0��4 min��Ӧ��Ũ�ȴ�0.5mol��L-1��
(4)��ӦH2(g)+ I2(g)=2HI(g)�ġ�H=436.0kJ��mol-1+152.7kJ��mol-1-298.7kJ��mol-1��2=-8.7kJ��mol-1���ʴ�Ϊ��-8.7��
(5)��a���÷�Ӧ�ﵽƽ��״̬ʱ��5v��NH3����=4v��N2��������a����
b���÷�Ӧ��һ����Ӧǰ�������������Ŀ��淴Ӧ������Ӧ�ﵽƽ��״̬ʱ��������ѹǿ����ʱ��ı仯���仯���������жϷ�Ӧ�Ƿ�ﵽƽ��״̬����b��ȷ��
c��������N2�����ʵ�������������ʱ��������仯˵��Ũ�Ȳ��ڸı䣬��c��ȷ��
d�����ʵ���֮�Ȳ���˵�����淴Ӧ������Ȼ���Ũ�Ȳ��䣬��d����
�ʴ�Ϊ��bc��
��ͼ��a��b���Ӧ�����ʹ�ϵ�Ƿ�Ӧ������У�����ͼ��a��b���Ӧ�����ʹ�ϵ��v��������v���棩����c��d��ﵽƽ��ʱ���������������棩��ȣ�cd�����ʵ������ٸı䣬�ʴ�Ϊ��cd��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݼ۲���ӶԻ������ۣ�����ԭ���ӻ��������Ϊsp2����Ϊ��������
A. CH3ClB. SO32��C. NF3D. CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ŵ�������Ի���������Ӱ����������أ��������������Ⱦ���еĵ��������Ϊ���ǹ�ע����Ҫ����֮һ��
��.����NH3�Ļ�ԭ�Կ������������������Ⱦ�����г�ȥNO����Ҫ��Ӧ���£�4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ��H��0
5N2(g)+6H2O(l) ��H��0
(1)д��һ�ֿ������NO��ת���ʵķ�����__________
(2)һ���¶��£��ں����ܱ������а���n(NH3)�Un(NO) =2�U3���뷴Ӧ�����������Ӧ�����������жϸ÷�Ӧ�ﵽƽ��״̬����___________
A.c(NH3)�Uc(NO) =2�U3 B.n(NH3)�Un(N2) ���� C.������ѹǿ���� D.�����ڻ��������ܶȲ��� E.1molN��H�����ѵ�ͬʱ������1molO��H��
(3)��֪�÷�Ӧ����v��=k����c4(NH3)��c6 (NO)��v��=k����cx(N2)��cy(H2O) (k����k���ֱ��������淴Ӧ���ʳ���)���÷�Ӧ��ƽ�ⳣ��K=k��/k��,��x=_____��y=_______��
(4)ij�о�С�齫2molNH3��3molNO��һ������O2����2L�ܱ������У���Ag2O�������淢��������Ӧ��NO��ת�������¶ȱ仯�������ͼ��ʾ��

����5min�ڣ��¶ȴ�420K���ߵ�580K����ʱ����NO��ƽ����Ӧ����v(NO)=_______;
�������������£��¶�580K֮��NO����N2��ת���ʽ��͵�ԭ�������___________��
��.������[(NH2)2CO]ˮ��Һ���յ�������Ҳ��һ�ֿ��еķ�����NO��NO2��ͬ��Ȼ����ͨ��������Һ�У��ܵ���ԭ������ȹ�ϵ��ͼ��

(5)������[(NH2)2CO]ˮ��Һ���������Ϊ1��1��NO��NO2��������ɽ�NԪ��ת��Ϊ�Ի����������塣д���÷�Ӧ�Ļ�ѧ����ʽ____��
(6)����NO��NO2��ȵ���ߣ��ܵ���ԭ�ʽ��͵���Ҫԭ����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�DZ������ȡ����Ӧ��ʵ��װ��ͼ������AΪ����֧�ܵ��Թܸ��Ƴɵķ�Ӧ�����������¶˿���һ��С�ף�����ʯ���ޣ��ټ�����������м�ۡ���д���пհף�
��1����Ӧ����A����μ�����ͱ��Ļ��Һ���������ھͷ�����Ӧ��д��A�з����л���Ӧ�Ļ�ѧ����ʽ(�л���д�ṹ��ʽ)___����Ӧ����___��
��2���Թ�C��Ӧʢ�ŵ�������___��
��3����Ӧ��ʼ�۲��Թ�D��E������ֱ���__��__��
��4��ͼ����Щװ�ÿ��Է�����?___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������O2����NH3�Ʊ������װ����ͼ��ʾ(�г�װ����)������˵������ȷ����

A.���θ����B�п�������ʯ�һ�����������
B.ʵ������У���Ϩ��ƾ��ƣ�װ��C�е��������������ֺ��ȣ�˵��װ��C�еķ�Ӧ����
C.���θ����D�е���ˮ�Ȼ��ƿ�����β���еİ�����ˮ����
D.װ��E�е�ʯ����Һ���ձ�죬˵����ƿ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϯ��������G�ڴ���ҩ��²��ϵȷ����й㷺Ӧ�á��ϳ�G��һ��·�����£�

��֪������Ϣ��
��
��1molB��������Ӧ������2molC����C���ܷ���������Ӧ��
��D���ڵ�ȡ��������������Է�������Ϊ106��
�ܺ˴Ź���������ʾF�����������ֻ�ѧ�������⡣
��
�ش��������⣺
��1����A����B�Ļ�ѧ����ʽΪ______________����Ӧ����Ϊ________��
��2��D�Ļ�ѧ������________����D����E�Ļ�ѧ����ʽΪ��_______________��
��3��G�Ľṹ��ʽΪ__________________��
��4��F��ͬ���칹���к��б������ж��֣������������칹�������к˴Ź�����������4��壬�������Ϊ6��2��2��1����____________����д�����е�һ�ֵĽṹ��ʽ����
��5���ɱ��ͻ�����C�����²���ɺϳ�N-�����������
![]()
��Ӧ����1��ѡ����Լ�Ϊ_______����Ӧ����2��ѡ����Լ�Ϊ________��I�Ľṹ��ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣� �����dzµ�������������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ��������ͼ��ʾ��װ����ȡ�����������ش��������⣺

��1��д����ȡ���������Ļ�ѧ��Ӧ����ʽ��������������
��2��Ũ����������ǣ�������������������������������
��3������̼������Һ����Ҫ��������������������
��4��װ����ͨ�����ĵ���Ҫ���ڱ���̼������Һ��Һ���ϣ����ܲ�����Һ�У�Ŀ���Ƿ�ֹ������������
��5����Ҫ���Ƶõ������������������Ӧ���õ�ʵ���������������������
��6������ʵ��ʱ����ʱ����ʢ������Ҵ����Թ�����뼸�����Ƭ����Ŀ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�Fe(OH)3(s)��Cu(OH)2(s)�ֱ�����Һ�дﵽ�����ܽ�ƽ��ı���ҺpH������������Ũ�ȵı仯��ͼ��ʾ����ͼ�����������жϴ������ (����)
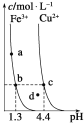
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. ������NH4Cl�����ʹ��Һ��a��䵽b��
C. c��d�����������Һ��c(H��)��c(OH��)�˻����
D. Fe(OH)3��Cu(OH)2�ֱ���b��c�����������Һ�дﵽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com