
【题目】根据价层电子对互斥理论,中心原子杂化轨道类型为sp2的微粒为( )
A. CH3ClB. SO32﹣C. NF3D. CO32﹣
【答案】D
【解析】
根据杂化轨道数判断杂化类型,杂化轨道数=价层电子对=σ 键电子对+中心原子上的孤电子对,σ键个数=配原子个数,孤电子对个数=![]() ,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断杂化类型。
,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断杂化类型。
A.CH3Cl中C形成4个σ键,无孤电子对,中心C原子为sp3杂化,A错误;
B.SO32-离子中的S形成3个σ 键,孤电子对数=![]() =1,价层电子对个数=3+1=4,则中心原子S杂化类型是sp3,B错误;
=1,价层电子对个数=3+1=4,则中心原子S杂化类型是sp3,B错误;
C.NF3分子中价层电子对个数=3+![]() =4,中心原子N原子杂化类型分别为sp3,C错误;
=4,中心原子N原子杂化类型分别为sp3,C错误;
D. CO32﹣中价层电子对个数=3+![]() =3,中心原子N原子杂化类型分别为sp2,D正确;
=3,中心原子N原子杂化类型分别为sp2,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)已知:①N2(g)+O2(g)2NO(g) ΔH=+180.5 kJ/mol;
②CO的燃烧热为283.0 kJ/mol。
则2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH=________kJ/mol。
(2)在恒温、恒容条件下,将2.0 mol NO和1.0 mol CO充入一个容积为2 L的密闭容器中发生上述反应,反应过程中部分物质的物质的量(n)变化如图所示。
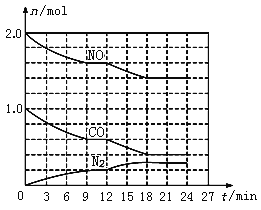
①N2在0~9 min内的平均反应速率v(N2)=________mol/(Lmin);
②第9 min时氮气的产率为________;
③第12 min时改变的反应条件可能为_______(填字母代号);
A.升高温度 B.加入NO C.加催化剂 D.减小压强 E.降低温度
④若在第24min将NO与N2的浓度同时增加到原来的2倍,化学平衡______移动(填“向正反应方向”、“逆反应方向”或“不”)。
(3)若将反应容器改为恒温容积可变的恒压密闭容器,压强为P=3.0MPa,反应物加入的物质的量不变,达到平衡时CO的转化率为50%,该温度下此反应平衡常数Kp=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:

回答下列问题:
(1)A的名称是________,B含有的官能团名称是________。
(2)反应④的反应类型是________。
(3)反应⑥的化学方程式为________。
(4)反应③⑤中引入-SO3H的作用是________。
(5)满足下列条件的C的同分异构体共有________种(不含立体异构)。
①能使FeCl3溶液显紫色;能发生水解反应。②苯环上有两个取代基。
其中核磁共振氢谱显示为5组峰,峰面积之比为3:2:2:2:1,且含有-CH2CH3,该有机物的结构简式是________ (任写一种)。
(6)以CH3CH2CH2OH为原料,设计制备 的合成路线:________。
的合成路线:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷(![]() )是一种最简单的环醚,常用于有机合成。某研究小组以环氧乙烷和甲苯为原料按下列流程合成有机化合物G和I。
)是一种最简单的环醚,常用于有机合成。某研究小组以环氧乙烷和甲苯为原料按下列流程合成有机化合物G和I。
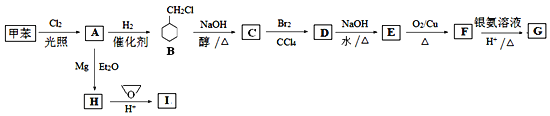
已知:CH3Cl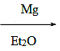 CH3MgCl
CH3MgCl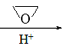 CH3CH2CH2OH
CH3CH2CH2OH
回答下列问题:
(1)A分子中最多有_____个原子共平面。
(2)D的结构简式为_____。
(3)写出下列反应的化学方程式:
E→F:______;G和I在浓硫酸催化下生成酯:______。
(4)I有多种同分异构体,写出其中满足以下条件的同分异构体的结构简式:_______。
①属于芳香族化合物; ② 能与FeCl3溶液发生显色反应;
③核磁共振氢谱显示不同环境的氢原子个数比1:2:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。

该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe(CO)5中铁的化合价为0,写出铁原子的简化的基态电子排布式______,Fe在周期表中第______周期______族,属于_______区。
(2)已知Fe(CO)5常温下呈液态,熔点为﹣20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体为________(填晶体类型)。
(3)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。
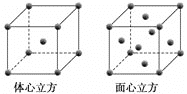
体心立方晶胞和面心立方晶胞中实际含有的铁原子个数之比为________;Fe原子配位数之比为____。若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞密度之比为_______。
(4)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如图所示(黑点代表铜原子,空心圆代表Y原子)。
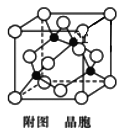
①该晶体的化学式为________。(用元素符号表示)
②已知该晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,则该晶胞边长为______nm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
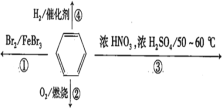
A.反应①为取代反应,有机产物与水混合后有机产物浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种烃类
D.一个苯分子含有三个碳碳双键,反应④中1mol苯最多与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉、封存与再利用是实现温室气体减排的重要途径之一。
(1)二氧化碳的电子式为___________。
(2)下列利用二氧化碳的反应中原子利用率达100%的是_____(填序号)。
a.CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b.CO2+CH4![]() CH3COOH
CH3COOH
c.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d.
(3)一种正在开发的利用二氧化碳制取甲醇的流程如下:

①反应(Ⅰ)将CO2和H2O转化为甲酸常用途径有两种,如下图(a)和 (b)。

图(a)中能量主要转化方式为____,图(b)中发生反应的化学方程式为_____。
②在5L的恒温恒容密闭容器中充入1moLCO和4molH2,加入催化剂发生反应,测得CO及CH3OH的物质的量随时间变化如下图所示。

图中第______min(填数字)反应达到平衡,CO在0~4min内的平均反应速率比在4~8min内的快,其原因是______;达到平衡时氢气的浓度为______。
(4)已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能,反应H2(g)+ I2(g)=2HI(g)相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的△H为_________kJ·mol-1。
(5)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_________(不定项选择)。
a.反应速率v( NH3) =v( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如下图所示,图中v(正)与v(逆)相等的点为______(选填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com